题目内容
【题目】“NaH2PO2还原法”制备高纯度氢碘酸和亚磷酸钠(Na2HPO3)的工业流程如图。
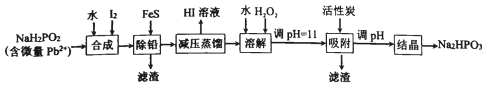
请回答:
(1)“合成”过程,主要氧化产物为亚磷酸(H3PO3),相应的化学方程式为______________。
(2)“除铅”过程,FeS除去微量Pb2+的离子方程式为_____________。
(3)“减压蒸馏”过程,I-回收率为95%,则剩余固体的主要成分为___________(填化学式)。
(4)“调pH=11”的作用为__________。
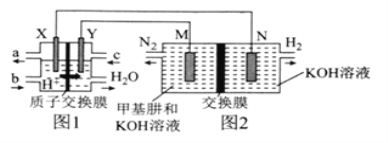
(5)工业上常用电解Na2HPO3溶液制备亚磷酸,其装置示意图:
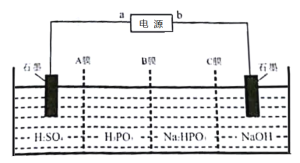
①a为电源______(填“正极”或“负极”)。
②B膜应选择___________(填“阴离子”“质子”或“阳离子”)交换膜。
③阳极的电极反应式为____________。
【答案】NaH2PO2+I2+H2O=H3PO3+NaI+HI FeS(s)+Pb2+(aq)=PbS(s)+Fe2+(aq) NaH2PO3 除铁、将NaH2PO3转换为Na2HPO3 正极 阴离子 2H2O-4e-=O2↑+4H+
【解析】
“合成”步骤,NaH2PO2和I2和水反应生成H3PO3和NaI和HI;之后加入FeS将Pb2+转化为PbS除去,此时溶液中的杂质为Fe2+;因为HI易挥发,“减压蒸馏”获得HI溶液,剩余固体主要为含有Fe2+杂质的NaH2PO3,加水溶解,再加入H2O2将Fe2+氧化成Fe3+,调pH=11将Fe3+转化为沉淀除去,同时部分NaH2PO3转换为了Na2HPO3;再次调pH将NaH2PO3彻底转化为Na2HPO3,最后“结晶”得到Na2HPO3固体,据此分析解答;
(5)电解的目的是利用Na2HPO3溶液制备亚磷酸,所以电解过程中Na2HPO3溶液中的HPO![]() 需要向左移动,电解池中阴离子流向阳极,所以左侧为电解池阳极,a为电源正极,b为电源负极。
需要向左移动,电解池中阴离子流向阳极,所以左侧为电解池阳极,a为电源正极,b为电源负极。
(1)根据后续流程可知“合成”步骤中产生HI,说明I2将NaH2PO2氧化,HI为强酸,所以还生成H3PO3和NaI,根据电子守恒和元素守恒可得该反应的化学方程式为:NaH2PO2+I2+H2O= H3PO3+NaI+HI;
(2)“除铅”过程,利用沉淀转化原理,加入FeS将Pb2+变成PbS,离子方程式为:FeS(s)+Pb2+(aq)=Fe2+(aq)+PbS(s);
(3)根据合成步骤的反应,可知蒸馏前溶液中主要含H3PO3、NaI和HI,而蒸馏过程I-回收率为95%,说明H3PO3和NaI反应有NaH2PO3生成,则剩余固体的主要成分为NaH2PO3;
(4)“调pH=11”的作用:将Fe3+转化为沉淀除去,同时将NaH2PO3转换为了Na2HPO3;
(5)①根据分析可知a为电源正极;
②电解过程中HPO![]() 需要穿过B膜,所以B膜应选择阴离子交换膜;
需要穿过B膜,所以B膜应选择阴离子交换膜;
③左侧与电源正极相连为阳极,阳极为硫酸溶液,水电离出的氢氧根放电生成氧气,电极反应式为2H2O-4e-=O2↑+4H+。

 阅读快车系列答案
阅读快车系列答案