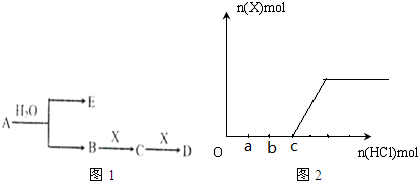题目内容
1.下列各物质按所含原子数由大到小顺序排列的是( )①0.3molNH3
②标准状况下的22.4L氯气
③9mLH2O(4℃)
④0.2mol磷酸.
| A. | ①④③② | B. | ④③②① | C. | ②④③① | D. | ①④②③ |
分析 根据n=$\frac{V}{{V}_{m}}$计算氯气物质的量,根据m=ρV计算水的质量,再根据n=$\frac{m}{M}$计算水的物质的量,结合分子式计算各物质含有原子总物质的量.
解答 解:①0.3molNH3 含有原子总物质的量为0.3mol×3=0.9mol;
②标准状况下,22.4L氯气的物质的量为$\frac{22.4L}{22.4L/mol}$=1mol,含有原子总物质的量为1mol×2=2mol;
③9mLH2O(4℃)的质量为9mL×1g/mL=9g,物质的量为$\frac{9g}{18g/mol}$=0.5mol,含有原子总物质的量为0.5mol×3=1.5mol;
④0.2mol磷酸含有原子总物质的量为0.2mol×8=1.6mol,
故所含原子数由大到小顺序排列为:②④③①,
故选:C.
点评 本题考查物质的量计算,比较基础,注意对化学式的理解,有利于基础知识的巩固.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案
相关题目
2.下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是( )
| A. | Cu(OH)2与盐酸,Cu(OH)2与醋酸 | |
| B. | BaCl2溶液与Na2SO4溶液,Ba(OH)2溶液与H2SO4溶液 | |
| C. | NaHCO3溶液与NaHSO4溶液,NaHCO3溶液与盐酸 | |
| D. | 石灰石与稀硝酸反应,生石灰与稀盐酸 |
16.工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料制取二氧化锰,其流程示意图如下:

已知:生成氢氧化物沉淀的pH
注:金属离子的起始浓度为0.1mol/L
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是增大接触面积,提高反应速率.盐酸溶解MnCO3的化学方程式是MnCO3+2HCl=MnCl2+CO2↑+H2O.
(2)向溶液1中加入双氧水时,反应的离子方程式是2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+.
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是MnS+Cu2+=Mn2++CuS.
(4)将MnCl2转化为MnO2的一种方法是氧化法.其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式为:□Mn2++□ClO3-+□4H2O=□Cl2↑+□5MnO2+□8H+.
(5)将MnCl2转化为MnO2的另一种方法是电解法.
①生成MnO2的电极反应式是Mn2+-2e-+2H2O=MnO2+4H+.
②若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2.检验Cl2的操作是将润湿的淀粉碘化钾试纸置于阳极附近,若试纸变蓝则证明有Cl2生成.
③若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生.其原因是其它条件不变下,增大Mn2+浓度[或增大c(Mn2+)/c(Cl-)],有利于Mn2+放电(不利于Cl-放电).

已知:生成氢氧化物沉淀的pH
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是增大接触面积,提高反应速率.盐酸溶解MnCO3的化学方程式是MnCO3+2HCl=MnCl2+CO2↑+H2O.
(2)向溶液1中加入双氧水时,反应的离子方程式是2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+.
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是MnS+Cu2+=Mn2++CuS.
(4)将MnCl2转化为MnO2的一种方法是氧化法.其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式为:□Mn2++□ClO3-+□4H2O=□Cl2↑+□5MnO2+□8H+.
(5)将MnCl2转化为MnO2的另一种方法是电解法.
①生成MnO2的电极反应式是Mn2+-2e-+2H2O=MnO2+4H+.
②若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2.检验Cl2的操作是将润湿的淀粉碘化钾试纸置于阳极附近,若试纸变蓝则证明有Cl2生成.
③若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生.其原因是其它条件不变下,增大Mn2+浓度[或增大c(Mn2+)/c(Cl-)],有利于Mn2+放电(不利于Cl-放电).
10.胶体分散系与其它分散系的本质区别是( )
| A. | 分散质粒子大小 | B. | 是否有丁达尔现象 | ||
| C. | 是否稳定 | D. | 分散质粒子是否带电 |
11.有关C2H6、C2H4、C2H2之叙述正确的是( )
| A. | C原子的轨道杂化类型分别为sp、sp2、sp3 | |
| B. | π键总数:C2H6>C2H4>C2H2 | |
| C. | σ键总数:C2H6>C2H4>C2H2 | |
| D. | 碳碳键间的键能:C2H6>C2H4>C2H2 |
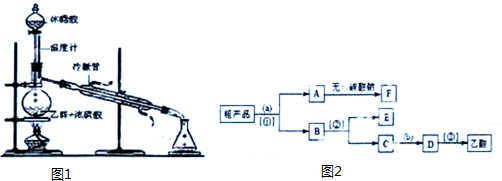
 CH3COOC2H5+H2O;
CH3COOC2H5+H2O;