题目内容
【题目】已知SO2可以用Fe(NO3)3溶液吸收,按如图所示装置展开相关探究:取一定量的铜片于三颈烧瓶中,通入一段时间N2后再加入足量的浓硫酸,加热;装置A中有白雾(硫酸酸雾)生成,装置B中产生白色沉淀。回答下列问题:
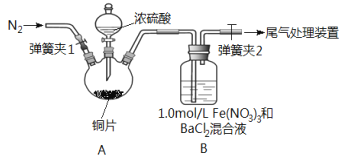
(1)装置A中用于添加浓硫酸的仪器名称为_________________。
(2)实验开始前需进行的操作是_____________________。
(3)加入浓硫酸之前先通入N2一段时间,其目的是_____________。
(4)排除装置A中白雾影响,可在装置A、B间增加洗气瓶C,则C中盛放的试剂是_______;若用NaOH溶液处理尾气,则发生反应的离子方程式为__________。
(5)经过讨论,该小组对装置B中产生沉淀的原因,提出下列假设(不考虑各因素的叠加,不考虑体系残留的氧气);
假设1:装置A中白雾进入装置B中参与了反应;
假设2:________;
假设3: Fe(NO3)3溶液显酸性,在此酸性条件下NO3-能氧化SO2。
(6)请你设计实验验证上述假设3,写出实验步骤、预期现象和结论。
实验步骤(简述操作过程) | 预期现象和结论 |
①测1.0mol/LFe(NO3)3溶液的pH ②取与Fe(NO3)3溶液中c(NO3-)相同的适量Ba(NO3)2溶液滴入试管中 ③______________ ④向试管中通入适量SO2气体 | _____________ |
(7)若假设2正确,请写出B中发生氧化还原反应的离子方程式:_________。
【答案】分液漏斗 检查装置的气密性 排除空气的干扰 饱和NaHSO3溶液 SO2+2OH-═SO32-+H2O SO2被Fe3+氧化为SO42- 向试管中滴加少许稀硝酸,调节pH与①相同 若有白色沉淀,则假设3成立;反之,则假设3不成立 2Fe3++SO2+2H2O═2Fe2++SO42-+4H+
【解析】
(1)装置A中用于添加浓硫酸的仪器为分液漏斗;
(2)实验中有气体参与反应,需要先检验装置的气密性;
(3)空气中氧气能氧化亚铁离子,干扰实验;
(4)C中盛放的物质能吸收硫酸且不能吸收二氧化硫、不能引进新的杂质;二氧化硫属于酸性氧化物,能和碱反应生成盐和水;
(5)铁离子具有氧化性,将SO2氧化为SO42-;
(6)要验证假设3,硝酸铁是强酸弱碱盐,其溶液呈酸性,要证明是酸性条件下硝酸根离子氧化二氧化硫,可以用硝酸的强碱盐溶液、少量稀硝酸,控制与硝酸铁溶液的pH相同、硝酸根离子浓度相同,然后向溶液中通入少量二氧化硫观察实验现象;
(7)若假设2正确,Fe3+将SO2氧化为SO42-,自身被还原为Fe2+,而后生成的SO42-与Ba2+反应生成BaSO4;
(1)装置A中用于添加浓硫酸的仪器为分液漏斗;
(2)A中制备二氧化硫,B中进行二氧化硫的性质实验,需要先检验装置的气密性;
(3)装置中含有空气,空气中氧气能氧化亚铁离子干扰实验,所以通入氮气的目的是排除空气的干扰;
(4)排除装置A中白雾影响,可在装置A.B间增加洗气瓶C,C中盛放的物质能吸收硫酸且不能吸收二氧化硫、不能引进新的杂质,则需要饱和NaHSO3溶液等;二氧化硫属于酸性氧化物,能和碱溶液发生反应生成盐和水,离子方程式为SO2+2OH=SO32+H2O;
(5)铁离子具有氧化性、二氧化硫具有还原性,可能是SO2被Fe3+氧化为SO42;
(6)要验证假设3,硝酸铁是强酸弱碱盐,其溶液呈酸性,要证明是酸性条件下硝酸根离子氧化二氧化硫,可以用硝酸的强碱盐溶液、少量稀硝酸,控制与硝酸铁溶液的pH相同、硝酸根离子浓度相同,然后向溶液中通入少量二氧化硫观察实验现象,其操作步骤为:
①测1.0mol/LFe(NO3)3溶液的pH
②取与Fe(NO3)3溶液中c(NO3)相同的适量Ba(NO3)2溶液滴入试管中;
③向试管中滴加少许稀硝酸,调节pH与①相同;
④向试管中通入适量SO2气体,
通过以上一系列操作,得到的结论为:如果溶液中有白色沉淀生成就说明假设3成立,否则假设3不成立;
(7)若假设2正确,Fe3+将SO2氧化为SO42,自身被还原为Fe2+,而后生成的SO42与Ba2+反应生成BaSO4,反应的相关离子方程式为:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+。

 名校课堂系列答案
名校课堂系列答案