��Ŀ����
����Ŀ��SO2�ǿ�������Ҫ�Ĵ�����Ⱦ����ҹ涨���ŷ�ǰ���뾭��������
��Һ���շ�����ҵ�ϳ���NaOH��Һ������Һ��
��1����0.5L1 mol��L��1��NaOH��Һ��ͨ���״̬��11.2L��SO2��
��д����Ӧ�����ӷ���ʽ__________��
����֪��Ka1��1.54��10��2��Ka2��1.02��10��7����������Һ��_______������ԡ��������ԡ������ԡ����������й�����Һ������Ũ�ȴ�С��ϵ��ȷ����_________��
A c��H2SO3����c��SO32����
B c��Na������c��H+����c��HSO3������2c��SO32������c��OH����
C c��Na������c��H2SO3����c��HSO3������c��SO32����
D c��Na������c��HSO3������c��SO32������c��H+����c��OH����
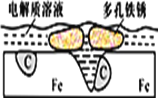
��2����ҵ��Ҳ������Na2SO3��Һ����SO2�����õ�ⷨ��������SO2��������Һ��ʵ������Һ�Ļ��������ã�װ������ͼ��ʾ��

�ٹ���һ��ʱ�����������Һ��pH_______�����������С�����䡱����
��д�������ĵ缫��Ӧʽ_______��
��SO2�Ļ������ã�
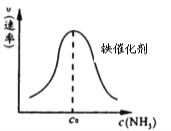
��3��SO2��Cl2��Ӧ���Ƶû����ȣ�SO2Cl2������ӦΪSO2��g����Cl2��g��![]() SO2Cl2��g������Ͷ�ϱ�1:1��SO2��Cl2����һ��ѹ���ܱ������з���������Ӧ��SO2��ת�������¶�T�Ĺ�ϵ����ͼ��ʾ��
SO2Cl2��g������Ͷ�ϱ�1:1��SO2��Cl2����һ��ѹ���ܱ������з���������Ӧ��SO2��ת�������¶�T�Ĺ�ϵ����ͼ��ʾ��

�� �÷�Ӧ����H________���������������������0��
�� ����Ӧһֱ������pѹǿ�����½��У���M��ķ�ѹƽ�ⳣ��Kp��_____���ú�p�ı���ʽ��ʾ����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ����ѹ�������������
���𰸡�2OH����SO2=HSO3�� ���� BC ���� HSO3����2e����2H2O=3H+��SO42�� �� 3/p
��������
��(1)�����ж�����NaHSO3���ٸ����غ�����жϹ�ϵ��
(2)������������Һ�е������ӷŵ磻
����װ��ͼ��֪���ұ�Ϊ���������ʧ�����ױ�����Ϊ�������Ϊ������
��(3)�ٽ���¶ȶԷ�Ӧ���ʵ�Ӱ��ش�
�ڸ�������ʽ��⡣
��(1) �ٱ�״����11.2L��SO2�����ʵ���Ϊ![]() =0.5mol��0.5L1 mol��L��1��NaOH�����ʵ���Ϊ
=0.5mol��0.5L1 mol��L��1��NaOH�����ʵ���Ϊ![]() =0.5mol����1��1��Ӧ������NaHSO3�������ӷ���ʽΪ2OH����SO2=HSO3�����ʴ�Ϊ2OH����SO2=HSO3����
=0.5mol����1��1��Ӧ������NaHSO3�������ӷ���ʽΪ2OH����SO2=HSO3�����ʴ�Ϊ2OH����SO2=HSO3����
����֪��Ka1��1.54��10��2��Ka2��1.02��10��7����֪HSO3���ĵ������ˮ�⣬��Һ�����ԣ�
A. HSO3���ĵ������ˮ��, �� c��H2SO3����c��SO32������A�����
B.���ݵ���غ㣺 c��Na������c��H+����c��HSO3������2c��SO32������c��OH������B����ȷ��
C.����Ԫ���غ㣺 c��Na������c��H2SO3����c��HSO3������c��SO32������C����ȷ��
D. HSO3���ĵ������ˮ�⣬��ˮ����������ӣ�����ȷ������Ϊc��Na������c��HSO3������c��H+����c��SO32������c��OH������D����ʴ�ΪBC��
(2)�ٵ����У�����������Һ�е������ӷŵ磬�缫��ӦʽΪ��2H++2e-=H2������pH���ʴ�Ϊ������
����װ��ͼ��֪���ұ�Ϊ���������ʧ�����ױ�����Ϊ�������Ϊ��������缫��ӦʽΪHSO3--2e-+2H2O��SO42-+3H+���ʴ�Ϊ��HSO3����2e����2H2O=3H+��SO42��
��3���ٸ���ͼ�������¶ȣ�SO2��ת���ʼ�С��˵��ƽ�������ƶ���˵���÷�Ӧ����ӦΪ���ȷ�Ӧ����H��0���ʴ�Ϊ����
����SO2�����ʵ���Ϊ1mol����Cl2�����ʵ���Ϊ1mol��������ʽ���£�
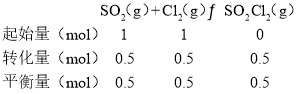
ƽ�ⳣ��K=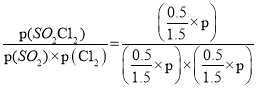
![]() =
=![]() ���ʴ�Ϊ��3/p��
���ʴ�Ϊ��3/p��

����Ŀ����֪SO2������Fe(NO3)3��Һ���գ�����ͼ��ʾװ��չ�����̽����ȡһ������ͭƬ��������ƿ�У�ͨ��һ��ʱ��N2���ټ���������Ũ���ᣬ���ȣ�װ��A���а������������������ɣ�װ��B�в�����ɫ�������ش��������⣺
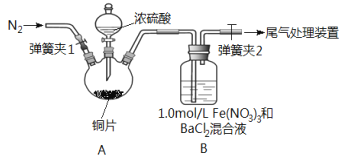
(1)װ��A����������Ũ�������������Ϊ_________________��
(2)ʵ�鿪ʼǰ����еIJ�����_____________________��
(3)����Ũ����֮ǰ��ͨ��N2һ��ʱ�䣬��Ŀ����_____________��
(4)�ų�װ��A�а���Ӱ�죬����װ��A��B������ϴ��ƿC����C��ʢ�ŵ��Լ���_______������NaOH��Һ����β����������Ӧ�����ӷ���ʽΪ__________��
(5)�������ۣ���С���װ��B�в���������ԭ��������м��裨�����Ǹ����صĵ���,��������ϵ��������������
����1��װ��A�а�������װ��B�в����˷�Ӧ��
����2:________��
����3: Fe(NO3)3��Һ�����ԣ��ڴ�����������NO3-������SO2��
(6)�������ʵ����֤��������3��д��ʵ�鲽�衢Ԥ������ͽ��ۡ�
ʵ�鲽��(������������) | Ԥ������ͽ��� |
�ٲ�1.0mol/LFe(NO3)3��Һ��pH ��ȡ��Fe(NO3)3��Һ��c(NO3-)��ͬ������Ba(NO3)2��Һ�����Թ��� ��______________ �����Թ���ͨ������SO2���� | _____________ |
(7)������2��ȷ����д��B�з���������ԭ��Ӧ�����ӷ���ʽ��_________��
����Ŀ������ʵ�鲻�ܴﵽĿ�ĵ��ǣ� ��
ѡ�� | Ŀ�� | ʵ�� |
A | ��ȡ�ϸ�Ũ�ȵĴ�������Һ | ��Cl2ͨ��С�մ���Һ�� |
B | ��ȥ�屽�е������� | �����������Һϴ�ӡ���Һ |
C | �ӿ��������������� | ����ϡ���ᷴӦ�Ĵ�п��Ϊ��п |
D | �Ʊ��������� | ��������ʯ���еμ�Ũ��ˮ |
A.AB.BC.CD.D