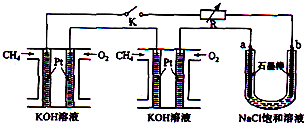
题目内容
2.如图为某化学兴趣小组设计的乙醇氧化的实验装置(图中加热仪器、铁架台、铁夹等均未画出).图中:A处为无水乙醇(沸点为78℃);B处为绕成螺旋状的细铜丝或银丝;C处为无水CuSO4粉末;D处为碱石灰;F处为新制的碱性Cu(OH)2悬浊液.
(1)在上述装置中,实验时需要加热的仪器按加热的先后顺序排列为(填序号)E、A、B、F.E处是一种纯净物,其发生反应的化学方程式为2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑.
(2)为使A中乙醇平稳气化成乙醇蒸气,常采用的方法是水浴加热.D处使用碱石灰的作用是防止F中的水蒸气进入到C中,影响实验.
(3)能证明乙醇反应后所生成的产物的实验现象是C由白色变为蓝色,F中出现砖红色沉淀.
(4)图中G处导管倾斜的作用是让混合气体的气流顺利流入到B中.
(5)本实验中若不加热E处,其他操作不变,则发现C处无明显变化,而F处现象与(3)相同,B处发生反应的化学方程式是CH3CH2OH$→_{△}^{Cu}$CH3CHO+H2↑.
分析 由实验装置可知,乙醇在铜催化作用下加热与氧气发生氧化还原反应生成乙醛和水,实验中E用于制备氧气,生成的氧气通入A中,形成氧气和乙醇的混合气体,在B中加热条件下反应生成乙醛和水,可用C检验水的生成,用新制的碱性Cu(OH)2悬浊液检验是否生成乙醛,以此解答该题.
解答 解:(1)固体加热制氧气需要加热,乙醇变为蒸汽需加热,乙醇的催化氧化要加热,醛和氧气的反应也要加热,实验时需要加热的仪器按加热的先后顺序排列为E、A、B、F;E处是一种纯净物,其发生反应的化学方程式为2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,
故答案为:E、A、B、F;2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
(2)为使A中乙醇平稳气化成乙醇蒸气,常采用的方法是水浴加热;D处使用碱石灰的作用是防止F中的水蒸气进入到C中,影响实验,
故答案为:水浴加热;防止F中的水蒸气进入到C中,影响实验;
(3)乙醇被氧化生成乙醛和水,水能使无水硫酸铜变蓝;在加热条件下,乙醛和新制的碱性Cu(OH)2悬浊液反应生成砖红色沉淀,如果C由白色变为蓝色,F中出现砖红色沉淀,说明乙醇被氧化后的产物是水和乙醛.
故答案为:C由白色变为蓝色,F中出现砖红色沉淀;
(4)G处导管倾斜的作用是让混合气体的气流顺利流入到B中,故答案为:让混合气体的气流顺利流入到B中;
(5)不加热E处,其他操作不变,则发现C处无明显变化,而F处现象与(3)相同,则B处发生反应的化学方程式是CH3CH2OH$→_{△}^{Cu}$ CH3CHO+H2↑,故答案为:CH3CH2OH$→_{△}^{Cu}$ CH3CHO+H2↑.
点评 本题考查性质实验方案的设计,为高频考点,把握乙醇的催化氧化实验、实验装置的作用等为解答的关键,侧重分析与实验能力的考查,题目难度中等.

| A. | 氮的非金属性弱 | B. | 氮气的熔沸点低 | ||
| C. | 氮原子半径较小 | D. | 氮分子中原子间共价键不易断裂 |
| A. | 0.8a g | B. | 0.0745b g | C. | 0.0376c g | D. | 无法计算 |
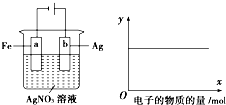 按图实验,若x轴表示流入阴极电子的物质的量,则y轴可表示①c(Ag+) ②c(NO3-)③a棒的质量④b棒的质量( )
按图实验,若x轴表示流入阴极电子的物质的量,则y轴可表示①c(Ag+) ②c(NO3-)③a棒的质量④b棒的质量( )| A. | ①③ | B. | ③④ | C. | ①②④ | D. | ①② |
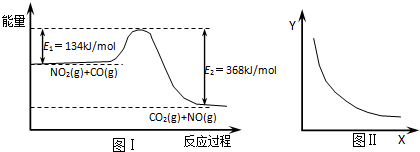
| A. | 该反应的焓变△H=234kJ/mol | |
| B. | 若X表示CO的起始浓度,则Y表示的可能是NO2的转化率 | |
| C. | 若X表示反应时间,则Y表示的可能是混合气体的密度 | |
| D. | 若X表示温度,则Y表示的可能是CO2的物质的量浓度 |
| A. | 取少量试液,加入用盐酸酸化的氯化钡溶液,有白色沉淀生成 | |
| B. | 取少量试液,加入氯化钡溶液,有白色沉淀生成,再加稀硝酸沉淀不消失 | |
| C. | 取少量试液,加入硝酸钡溶液,有白色沉淀生成 | |
| D. | 取少量试液,加入盐酸无现象,再加氯化钡溶液,有白色沉淀生成 |
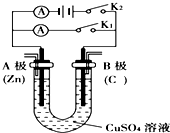 请按要求回答下列问题.
请按要求回答下列问题.