题目内容
13.某固体KOH样品含H2O 7.55%、含K2CO3 4.32%,将a g此样品与bmL 1mol/L盐酸反应完全,再用c mol/L KOH溶液25.12mL恰好使剩余盐酸中和.所得的溶液蒸干后,固体的质量为( )| A. | 0.8a g | B. | 0.0745b g | C. | 0.0376c g | D. | 无法计算 |
分析 将a g此样品与bmL 1mol/L盐酸反应完全,再用c mol/L KOH溶液25.12mL恰好使剩余盐酸中和,此时溶质为KCl,根据盐酸中HCl的物质的量可以得出氯化钾的物质的量,最后得到的即为氯化钾,然后根据m=nM计算出氯化钾的质量即可.
解答 解:将a g此样品与bmL 1mol/L盐酸反应完全,再用c mol/L KOH溶液25.12mL恰好使剩余盐酸中和,完全反应后溶液中溶质为KCl,根据Cl原子守恒可知:n(KCl)=n(HCl)=1mol/L×0.001bL=0.001bmol,
所以最后得到固体的质量为:74.5g/mol×0.001bmol=0.0745bg,
故选B.
点评 本题考查了混合物反应的计算,题目难度中等,明确反应后溶质组成及质量守恒定律为解答关键,试题侧重考查学生的分析能力及化学计算能力.

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
3.32g铜跟适量的浓硝酸反应,铜全部作用后,共收集到NO、NO2混合气体22.4L(标准状况下),则反应消耗的硝酸的物质的量是( )
| A. | 1.0 mol | B. | 1.5 mol | C. | 2.0 mol | D. | 2.5 mol |
4.有机物分子结构中基团之间的相互影响会导致物质化学性质的改变,下列各项的事实不能说明上述观点的是( )
| A. | 甲苯能使酸性高锰酸钾溶液褪色,而甲烷不能 | |
| B. | 乙醇电离出H+的能力不及H2O | |
| C. | 乙烯能发生加成反应,而乙烷不能发生加成反应 | |
| D. | 苯酚能与NaOH溶液反应,而乙醇不能与NaOH溶液反应 |
8.2009年12月7-18日在丹麦首都哥本哈根,召开了全球气候会议,商讨2012年至2020年的全减排协议.下列行为中不符合“促进低碳经济”宗旨的是( )
| A. | 发展水电,开发新能源,如核能、太阳能、风能等,减少对矿物能源的依赖 | |
| B. | 限制化学发展,关停化工企业,消除污染源头 | |
| C. | 推广煤的气化、液化技术,提供清洁、高效燃料和基础化工原料,挖掘使用价值 | |
| D. | 推广利用微生物发酵技术,将植物桔杆、动物粪便等制成沼气以替代液化石油气 |
18.已知碳碳单键可以绕键轴自由旋转,结构简式为如图所示的烃,下列说法中正确的是( )

| A. | 分子中至少有12个碳原子处于同一平面上 | |
| B. | 分子中至少有10个碳原子处于同一平面上 | |
| C. | 分子中至少有11个碳原子处于同一平面上 | |
| D. | 该烃属于苯的同系物 |
5.能增加反应物分子的活化分子的百分数,同时可以改变化学平衡常数的是( )
| A. | 升高温度 | B. | 使用催化剂 | C. | 增大压强 | D. | 增加浓度 |
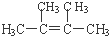 ;
;

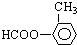 还有:
还有: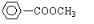 .
.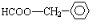 .
.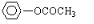

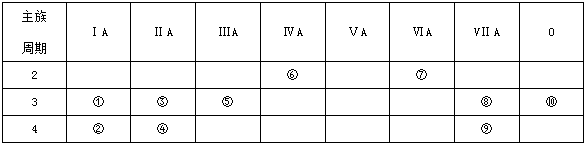
 ,用电子式表示⑦号元素氢化物的形成过程是
,用电子式表示⑦号元素氢化物的形成过程是 ,⑦号元素氢化物和元素②反应的离子方程式:2K+2H2O=2K++2OH-+H2↑.
,⑦号元素氢化物和元素②反应的离子方程式:2K+2H2O=2K++2OH-+H2↑.