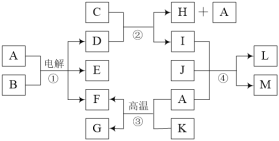
题目内容
【题目】在一定条件下,Na2S溶液中存在水解平衡:S2-+H2O![]() HS-+OH-。下列说法正确的是( )
HS-+OH-。下列说法正确的是( )
A. 稀释溶液,水解平衡常数增大B. 加入CuSO4固体,HS-浓度减小
C. 升高温度,c(HS-)/c(S2-)减小D. 加入NaOH固体,溶液pH减小
【答案】B
【解析】
A.平衡常数仅与温度有关,温度不变,则稀释时平衡常数是不变的,A错误;
B.加入CuSO4固体,硫离子与铜离子结合生成硫化铜沉淀,使S2-+H2O![]() HS-+OH-逆向移动,HS-浓度减小,B正确;
HS-+OH-逆向移动,HS-浓度减小,B正确;
C.水解反应是吸热反应,升温促进水解,平衡正移,c(S2-)减小,c(HS-)增大,所以c(HS-)/c(S2-)增大,C错误;
D.加入NaOH固体,由于氢氧化钠是一种强碱,溶液pH增大,D错误;
答案选B。

 阅读快车系列答案
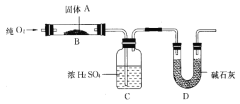
阅读快车系列答案【题目】某化学小组同学用下列装置和试剂进行实验,探究O2与KI溶液发生反应的条件。
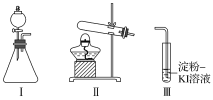
供选试剂:30%H2O2溶液、0.1mol/L H2SO4溶液、MnO2固体、KMnO4固体
(1)小组同学设计甲、乙、丙三组实验,记录如下
操作 | 现象 | |
甲 | 向I的锥形瓶中加入___,向I的____中加入30%H2O2溶液,连接I、Ⅲ,打开活塞 | I中产生无色气体并伴随大量白雾;Ⅲ中有气泡冒出,溶液迅速变蓝 |
乙 | 向Ⅱ中加入KMnO4固体,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液不变蓝 |
丙 | 向Ⅱ中加入KMnO4固体,Ⅲ中加入适量0.1mol/LH2SO4溶液,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液变蓝 |
(2)丙实验中O2与KI溶液反应的离子方程式是____。
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是___。为进一步探究该条件对反应速率的影响,可采取的实验措施是___。
(4)由甲、乙、丙三实验推测,甲实验可能是I中的白雾使溶液变蓝。学生将I中产生的气体直接通入下列_____(填字母)溶液,证明了白雾中含有H2O2。
A.酸性KMnO4 B.FeC12 C.Na2S D.品红
【题目】今有一澄清溶液,只可能含有下表中的若干种离子(存在的离子均大量):
阳离子 | K+、NH4+、H+、Ba2+ |
阴离子 | Cl-、CO32-、SO42-、OH- |
现取三份上述澄清溶液各100 mL,分别进行以下实验:
①第一份加入AgNO3溶液有沉淀产生。
②第二份加入足量NaOH溶液加热后,收集到气体0.04 mol。
③第三份加入足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤,干燥后,沉淀质量为2.33 g。
请回答下列问题:
(1)根据第②个实验可以确定存在的离子是_______;
(2)除(1)中确定存在的离子以外,还一定存在的离子是__________,可能存在的离子是______;
(3)第③个实验中沉淀减少的原因是(用离子方程式表示)______________。