题目内容
5.如图为铜锌原电池示意图,下列说法正确的是( )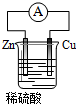
| A. | 负极发生氧化反应 | B. | 烧杯中的溶液变为蓝色 | ||
| C. | 电子由铜片通过导线流向锌片 | D. | 该装置能将电能转变为化学能 |
分析 由图中的铜锌原电池可知,Zn活泼,则Zn作负极失电子发生氧化反应,Cu作正极得电子发生还原反应,发生电池反应为Zn+H2SO4═ZnSO4+H2↑,电子由负极流向正极,该装置将化学能转变为电能,以此来解答.
解答 解:A、因Zn作负极,则Zn失去电子发生氧化反应,故A正确;
B、由发生电池反应为Zn+H2SO4═ZnSO4+H2↑,Cu不反应,则烧杯中溶液为无色,故B错误;
C、Zn作负极,Cu作正极,则电子由锌片通过导线流向铜片,故C错误;
D、该装置通过化学反应将化学能转变为电能,故D错误;
故选:A.
点评 本题考查原电池的工作原理,明确电极的判断、电极反应、电池反应、能量转化等即可解答,难度不大.

练习册系列答案
相关题目
10.有一种有机化合物,其结构简式如图: ,下列有关它的性质的叙述中,正确的是( )
,下列有关它的性质的叙述中,正确的是( )
 ,下列有关它的性质的叙述中,正确的是( )
,下列有关它的性质的叙述中,正确的是( )| A. | 有弱酸性,1 mol该有机物与溴水反应,最多能消耗4mol Br2 | |
| B. | 在一定条件下,1mol该物质最多能与6mol NaOH完全反应 | |
| C. | 在Ni催化下,1 mol 该物质可以和7mol H2发生加成反应 | |
| D. | 它能发生水解反应,水解后只能生成两种产物 |
11.某化学兴趣小组对某“氢铵”化肥进行了专项研究:
(1)预测:根据已有知识和“氢铵”的名称,该小组预测该“氢铵”是碳酸或亚硫酸或硫酸的铵盐.
(2)实验和探究:
①NH4+的验证:取少量固体药品于试管中,然后滴加NaOH浓溶液,加热试管,将湿润的红色石蕊试纸置于试管口部,若红色石蕊试纸变蓝,则证明含NH4+.
②阴离子的探究:取少量固体药品于试管中,然后向试管中滴加稀盐酸,固体全部溶解,将产生的气体通入图1装置.观察到的现象是溴水无明显变化,澄清石灰水变浑浊.再向滴加稀盐酸反应后的试管中加Ba(OH)2溶液,无明显现象.
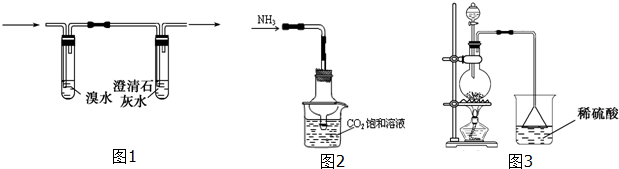
初步结论:“氢铵”是碳酸的铵盐.
③思考:上述实验步骤②加入Ba(OH)2溶液的目的是检验是否存在SO42-.根据初步实验结论,提出假设:
假设1:氢铵成分是NH4HCO3 假设2:氢铵成分是(NH4)2CO3
假设3:氢铵成分是(NH4)2CO3和NH4HCO3的混合物.
④根据上述假设,设计实验得出结论.限选试剂和仪器有:CaCl2溶液、品红溶液、Ba(NO3)2溶液、1.0mol/L盐酸、1.0mol•L-1 NaOH溶液、饱和澄清石灰水、BaCl2溶液、Ba(OH)2溶液、试管、胶头滴管
(3)延伸探究:
①根据氢铵成分,设计小组根据下面实验装置来制备NH4HCO3是否合理否(填“是”或“否”)
②该实验小组设计了以下实验方案测定氢铵中的含氮量,请你阅读后进行评价:准确称取一定质量的样品,放入图2方案的烧瓶中,滴加过量NaOH浓溶液,充分微热,按如图3装置,通过实验测定烧杯增加的质量(忽略漏斗中附着溶液的质量).然后进行计算,可得化肥的含氮量.请你评价上述方案是否合理.若合理只需要说明结论;若不合理,请简要说明原因,并指出修改方案(若要添加仪器、药品,请说明添加的位置、名称)
不合理,装置中没有干燥装置,稀硫酸吸收了较多水蒸气,误差太大;在烧杯前加一个装有碱石灰的干燥管.
(1)预测:根据已有知识和“氢铵”的名称,该小组预测该“氢铵”是碳酸或亚硫酸或硫酸的铵盐.
(2)实验和探究:
①NH4+的验证:取少量固体药品于试管中,然后滴加NaOH浓溶液,加热试管,将湿润的红色石蕊试纸置于试管口部,若红色石蕊试纸变蓝,则证明含NH4+.
②阴离子的探究:取少量固体药品于试管中,然后向试管中滴加稀盐酸,固体全部溶解,将产生的气体通入图1装置.观察到的现象是溴水无明显变化,澄清石灰水变浑浊.再向滴加稀盐酸反应后的试管中加Ba(OH)2溶液,无明显现象.

初步结论:“氢铵”是碳酸的铵盐.
③思考:上述实验步骤②加入Ba(OH)2溶液的目的是检验是否存在SO42-.根据初步实验结论,提出假设:
假设1:氢铵成分是NH4HCO3 假设2:氢铵成分是(NH4)2CO3
假设3:氢铵成分是(NH4)2CO3和NH4HCO3的混合物.
④根据上述假设,设计实验得出结论.限选试剂和仪器有:CaCl2溶液、品红溶液、Ba(NO3)2溶液、1.0mol/L盐酸、1.0mol•L-1 NaOH溶液、饱和澄清石灰水、BaCl2溶液、Ba(OH)2溶液、试管、胶头滴管
| 实验步骤 | 预期现象及结论 |
| 步骤1:取适量“氢铵”配制成溶液,取1~2ml试液于一支洁净的试管中,加足量BaCl2溶液,充分振荡. | ①若出现白色沉淀,证明氢铵中含有(NH4)2CO3; ②若没有明显现象可能含有NH4HCO3 |
| 步骤2:静置,取上层清液少许于另一试管中, 继续滴加滴加适量Ba(OH)2溶液,振荡观察现象. | 若出现白色沉淀,证明氢铵中含有NH4HCO3结合步骤1②,则假设1成立; 结合步骤1①,则假设3成立; 仅在步骤1中产生白色沉淀,则假设2成立;. |
①根据氢铵成分,设计小组根据下面实验装置来制备NH4HCO3是否合理否(填“是”或“否”)
②该实验小组设计了以下实验方案测定氢铵中的含氮量,请你阅读后进行评价:准确称取一定质量的样品,放入图2方案的烧瓶中,滴加过量NaOH浓溶液,充分微热,按如图3装置,通过实验测定烧杯增加的质量(忽略漏斗中附着溶液的质量).然后进行计算,可得化肥的含氮量.请你评价上述方案是否合理.若合理只需要说明结论;若不合理,请简要说明原因,并指出修改方案(若要添加仪器、药品,请说明添加的位置、名称)
不合理,装置中没有干燥装置,稀硫酸吸收了较多水蒸气,误差太大;在烧杯前加一个装有碱石灰的干燥管.
13.下列做法不能有效改善大气质量的是( )
| A. | 大量生产、使用能过滤PM2.5的口罩 | |
| B. | 用石灰对煤燃烧后形成的烟气进行脱硫处理 | |
| C. | 开发利用太阳能、氢能、风能等清洁能源 | |
| D. | 研究廉价、高效的催化剂,以降低汽车尾气中有害物质的含量 |
20.下列叙述正确的是( )
| A. | ${\;}_{8}^{16}$O和${\;}_{8}^{18}$O互称同素异形体 | B. | 丙烷和异丁烷互称同系物 | ||
| C. | 金刚石和石墨互称同位素 | D. | 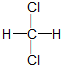 和 和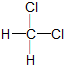 互称同分异构体 互称同分异构体 |
10.下列反应过程中的能量变化情况符合如图的是( )
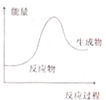

| A. | 乙醇的燃烧 | B. | 碳酸钙的分解 | ||
| C. | 镁和盐酸的反应 | D. | 酸和碱的中和反应 |
17.下列有关Na2CO3和NaHCO3的叙述正确的是( )
| A. | 在相同温度下,Na2CO3比NaHCO3的溶解度小 | |
| B. | 可用澄清石灰水鉴别Na2CO3溶液和NaHCO3溶液 | |
| C. | 可用加热的方法除去Na2CO3中混有的NaHCO3杂质 | |
| D. | Na2CO3和NaHCO3固体分别与盐酸反应产生等量的CO2时,后者消耗的H+多 |
14.二氧化碳的捕集、利用与封存(CCUS)是我国能源领域的一个重要战略方向,CCUS或许发展成一项重要的新兴产业.
(1)已知:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H1=a kJ•mol-1
CO(g)+H2O (g)═CO2(g)+H2 (g)△H2=b kJ•mol-1
2CO(g)+O2(g)═2CO2(g)△H3=c kJ•mol-1
反应CO2(g)+CH4(g)═2CO(g)+2H2(g) 的△H=a+2b-2ckJ•mol-1.
(2)利用废气中的CO2为原料制取甲醇,反应方程式为:CO2+3H2═CH3OH+H2O其他条件相同,该甲醇合成反应在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CO2的转化率随反应温度的变化如图1所示.
①a点所代表的状态不是(填“是”或“不是”)平衡状态.
②c点CO2的转化率高于b点,原因是b、c点都未达到平衡状态,c点温度高,反应速率快,二氧化碳的转化率较大.
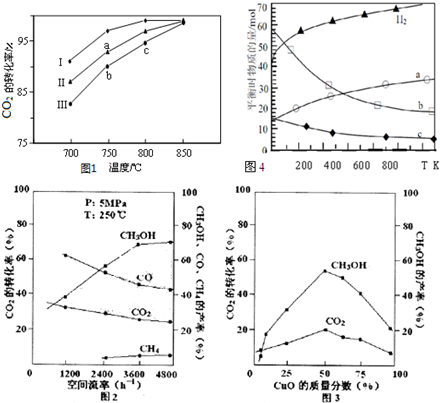
(3)在实际生产中发现,随着甲醇的生成,还伴随有少量CO副产物出现:CO2+H2?CO+H2O,且CO2的转化率、甲醇的产率和CO含量除受浓度、度、压强等因素影响外,还受催化剂CuO的质量分数、气体混合物在反应锅炉内的流动速率影响(用空间流率表示).通过实验分别得到数据图2、3:
①由图2得,最佳空间流率为3600h-1;
②在其他条件不变的前提下调整催化剂配比,并记录到达平衡所需的时间,得到如如表数据,试说明不选择单组份ZnO原因是使用单组分ZnO时反应速率虽然快,但是由图3可知,二氧化碳转化率、甲醇的产率都过低,实际生产中没有意义,故不采用.
(4)用二氧化碳催化加氢来合成低碳烯烃,起始时以0.1MPa,n(H2):n(CO2)=3:1的投料比充入反应器中,发生反应:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图4所示:
①该进行的反应的△S<0(填:“>”或“<”)
②对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),则该反应的KP=$\frac{p({C}_{2}{H}_{4})•{p}^{4}({H}_{2}O)}{{p}^{2}(C{O}_{2})•{p}^{6}({H}_{2})}$.
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是增大压强;提高氢气和二氧化碳物质的量的比值(列举2项).
(1)已知:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H1=a kJ•mol-1
CO(g)+H2O (g)═CO2(g)+H2 (g)△H2=b kJ•mol-1
2CO(g)+O2(g)═2CO2(g)△H3=c kJ•mol-1
反应CO2(g)+CH4(g)═2CO(g)+2H2(g) 的△H=a+2b-2ckJ•mol-1.
(2)利用废气中的CO2为原料制取甲醇,反应方程式为:CO2+3H2═CH3OH+H2O其他条件相同,该甲醇合成反应在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CO2的转化率随反应温度的变化如图1所示.
①a点所代表的状态不是(填“是”或“不是”)平衡状态.
②c点CO2的转化率高于b点,原因是b、c点都未达到平衡状态,c点温度高,反应速率快,二氧化碳的转化率较大.

(3)在实际生产中发现,随着甲醇的生成,还伴随有少量CO副产物出现:CO2+H2?CO+H2O,且CO2的转化率、甲醇的产率和CO含量除受浓度、度、压强等因素影响外,还受催化剂CuO的质量分数、气体混合物在反应锅炉内的流动速率影响(用空间流率表示).通过实验分别得到数据图2、3:
①由图2得,最佳空间流率为3600h-1;
②在其他条件不变的前提下调整催化剂配比,并记录到达平衡所需的时间,得到如如表数据,试说明不选择单组份ZnO原因是使用单组分ZnO时反应速率虽然快,但是由图3可知,二氧化碳转化率、甲醇的产率都过低,实际生产中没有意义,故不采用.
| 催化剂组分质量分数(%) | CuO | 0 | 25 | 50 | 75 | 100 |
| ZnO | 100 | 75 | 50 | 25 | 0 | |
| 到达平衡所需时间(h) | 2.5 | 7.4 | 8.1 | 12 | 无催化活性 | |
①该进行的反应的△S<0(填:“>”或“<”)
②对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),则该反应的KP=$\frac{p({C}_{2}{H}_{4})•{p}^{4}({H}_{2}O)}{{p}^{2}(C{O}_{2})•{p}^{6}({H}_{2})}$.
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是增大压强;提高氢气和二氧化碳物质的量的比值(列举2项).
15.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | 饱和氯水中:Cl-、NO3-、Na+、CO32- | |
| B. | c(H+)=1.0×10-13mol•L的溶液中:MnO4-、K+、SO42-、AlO2- | |
| C. | c(AlO2-)=1.0mol•L的溶液中:SO42-、K+、Cl-、HCO3- | |
| D. | pH=7的溶液中:NO2-、I-、Na+、Fe3+ |