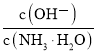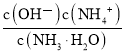题目内容
【题目】KH2PO4在农业上用作高效磷钾复合肥,在化学工业中还用作制偏磷酸钾的原料。一种电解法制备KH2PO4的装置如图所示。下列说法错误的是( )
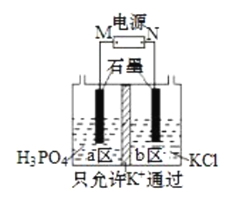
A.电源M极为负极,a区生成KH2PO4
B.b区电极反应为:4OH--4e-=O2↑+2H2O
C.电解过程中a区水的电离平衡正向移动
D.当0.1molK+通过离子交换膜时,阴阳两极产生的气体共2.24L(标准状况)
【答案】B
【解析】
a区含有磷酸,如生成KH2PO4,则应消耗氢离子,且钾离子进入a区,则a区为阴极,发生反应为2H++2e-=H2↑,b为阳极,发生2Cl--2e-=Cl2↑,M为负极,N为正极,以此解答该题。
A.由以上分析可知M为负极,a为阴极,生成KH2PO4,故A正确;
B.b区为阳极,发生氧化反应生成氯气,电极方程式为2Cl--2e-=Cl2↑,故B错误;
C.a区为阴极,氢离子浓度降低,对水的电离的抑制减小,则水的电离正向移动,故C正确;
D.当0.1mol K+通过离子交换膜时,则转移0.1mol电子,由电极方程式2H++2e-=H2↑、2Cl--2e-=Cl2↑可知两极各生成0.05mol气体,共0.1mol,体积为2.24L,故D正确。
故选:B。

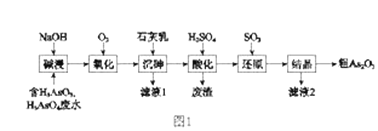
【题目】含有Cu、Fe、Al、Co、Li、Si等成分的某合金废料回收利用的工艺流程如图所示。

已知:
①Fe、Co在周期表中属同周期、同族;常温下,pH=7.3时Li+或Co3+开始沉淀。
②有关物质的溶度积(Ksp):
物质 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
Ksp | 4.0×10-21mol3·L-3 | 1.0×10-32mol4·L-4 | 1.0×10-38mol4·L-4 | 8.0×10-19mol3·L-3 |
回答下列问题
(1)Na2CO3溶液可作为合金废料的油污除剂,用离子方程式表示其原理__。
(2)“浸出渣”中的物质为__。
(3)①“浸出液”加入双氧水的作用是__(用离子方程式表示)。
②氨水的作用是调节溶液的pH,常温下,使溶液中杂质离子刚好沉淀完全而全部除去(浓度小于1.0×10-5mol·L-1认为完全沉淀)。需调节溶液的pH范围为__。
(4)得到的CoC2O4·2H2O晶体在空气中充分焙烧可得Co2O3,化学方程式为__。
(5)已知Li2CO3微溶于水,其饱和溶液的浓度与温度的关系如表所示。
温度/℃ | 10 | 30 | 60 |
浓度/(mol·L-1) | 0.21 | 0.17 | 0.14 |
则操作X为蒸发浓缩、__,理由是__。
【题目】利用下图装置可以进行实验并能达到实验目的的是
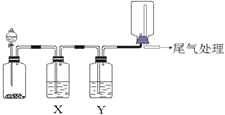
选项 | 实验目的 | X中试剂 | Y中试剂 |
A[] | 用MnO2和浓盐酸制取并收集纯净干燥的Cl2 | 饱和食盐水 | 浓硫酸 |
B | 用Cu与稀硝酸制取并收集纯净干燥的NO | 水 | 浓硫酸 |
C | 验证电石与饱和食盐水反应生成的气体的性质并收集 | CuSO4溶液 | KMnO4 |
D | CaCO3和稀盐酸制取并收集纯净干燥的CO2 | 饱和NaHCO3溶液 | 浓硫酸 |
A. A B. B C. C D. D