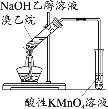
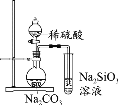
题目内容
【题目】如图是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题:
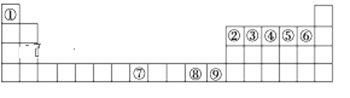
(1)根据元素原子的外围电子排布特征,元素周期表可划分为五个区域,元素⑦位于周期表的___区。
(2)写出元素③与元素⑤形成的稳定化合物的结构式___________。
(3)②、⑥两元素形成的化合物的立体构型为_______,其中心原子的杂化轨道类型为______。
(4)元素⑦与CO可形成X(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断该化合物晶体属于_____晶体(填晶体类型)。
(5)⑧的二价阳离子与过量的④的简单氢化物的水溶液作用的离子方程式_________。
(6)元素⑨的离子的氢氧化物不溶于水,但可溶于氨水中,该离子与NH3间结合的作用力为____。
(7)将①、⑥形成的化合物溶于水,其中可能存在的氢键表示为_______(写一种即可)。
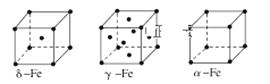
(8)金属⑦有δ、γ、α三种同素异形体,各晶胞如下图,则δ和α中原子的配位数之比为______。
【答案】d O=C=O 平面三角形 sp2杂化 分子晶体 Cu2++4NH3·H2O=[Cu(NH3)4]2++4H2O 配位键 F-H…F、F-H…O、O-H…F、O-H…O 4:3
【解析】
由元素在周期表中位置,可知①为H、②为B、③为C、④为N、⑤为O、⑥为F、⑦为Fe、⑧为Cu、⑨为Zn,据此解答。
(1)⑦为Fe,铁原子的核外电子排布式为:1s22s22p63s23p63d64s2,处于周期表中d区;
(2)元素③与元素⑤形成的稳定化合物为二氧化碳,其结构式为:O=C=O;
(3)②为B,⑥为F,形成的化合物为BF3,中心原子B的价层电子对数=3+![]() (3-1×3)=3,立体构型为平面三角形,其中心原子的杂化轨道类型为sp2杂化;
(3-1×3)=3,立体构型为平面三角形,其中心原子的杂化轨道类型为sp2杂化;
(4)元素⑦与CO可形成的Fe(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5℃,沸点为103℃,熔沸点低,易溶于非极性溶剂,属于分子晶体;
(5)元素⑧为铜元素,④为氮元素,其氢化物的水化物为氨水,铜离子与氨水反应生成铜氨配离子和水,反应的离子方程式为:Cu2++4NH3·H2O=[Cu(NH3)4]2++4H2O;
(6)元素⑨的离子的氢氧化物不溶于水,但可溶于氨水中生成配离子,Zn2+离子与NH3间结合的作用力为配位键;
(7)①为H,⑥为F,①、⑥形成的化合物为HF,溶于水,HF分子间和水分子间以及HF分子和水分子间都可形成氢键,氢键表示为F-H…F、F-H…O、O-H…F、O-H…O(写一种即可);
(8)δ为体心立方堆积,配位数为8;α为简单立方堆积,配位数为6,则δ和α中原子的配位数之比为8:6=4:3。

 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案【题目】钒及其化合物在工业上有许多用途。某钒精矿的主要成分及质量分数如下表:
物质 | V2O5 | V2O3 | K2O | SiO2 | Fe2O3 | Al2O3 |
质量分数% | 0.81 | 1.70 | 2.11 | 63.91 | 5.86 | 12.51 |
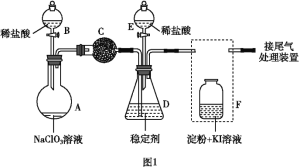
一种从该钒精矿中提取五氧化二钒的流程如下:
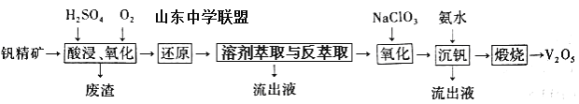
回答下列问题:
(1)“酸浸、氧化”时,V2O3转化为VO2+,反应的离子方程式为____________________________________;若用浓盐酸代替硫酸,V2O5转化为VO2+,同时生成有毒的黄绿色气体,反应的化学方程式为__________________。
(2)萃取剂对四价钒具有高选择性,且萃取Fe3+而不萃取Fe2+,所以萃取前可用____________(填名称,下同)对浸出液进行“还原”处理。为检验“还原”后的滤液中是否含有Fe3+,可选用的化学试剂是____________________。
(3)“溶剂萃取与反萃取”可表示为:VO2+ + (HR2PO4)2(O)![]() VO(R2PO4)2(O)+ 2H+。其中(HR2PO4)2(O)为萃取剂,为了提高VO2+的产率,反萃取剂应该呈 __________性(填“酸”“碱”或“中”)。
VO(R2PO4)2(O)+ 2H+。其中(HR2PO4)2(O)为萃取剂,为了提高VO2+的产率,反萃取剂应该呈 __________性(填“酸”“碱”或“中”)。
(4)“氧化”中,欲使3molVO2+变为VO2+,则需要氧化剂NaClO3至少为____________mol。
(5)单质钒可用于制造特种合金钢。以五氧化二钒和金属钙为原料在高温条件下可制备单质钒,表示制备过程的化学方程式为________________________________________。