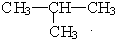题目内容
5.若发现114号元素X,它的最外层有4个电子,则下列有关它的叙述正确的是( )| A. | X的气态氢化物的稳定性比甲烷强 | B. | X的最高价氧化物是XO2 | ||
| C. | X应为非金属元素 | D. | X的最高价氧化物的水化物是强酸 |
分析 根据电子排布规律写出该原子原子结构示意图,根据电子层数判断周期数,根据价电子判断所属族数,根据在周期表中的位置判断判断其化合物的性质.
解答 解:该原子的原子结构示意图为: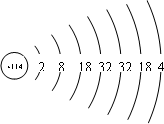 ,最外层有4个电子,属于第IVA族元素,在铅元素下方,金属性比铅强,
,最外层有4个电子,属于第IVA族元素,在铅元素下方,金属性比铅强,
A.同主族从上到下,氢化物的稳定性减弱,则X的气态氢化物的稳定性比甲烷弱,故A错误;
B.X元素的原子最外层有4个电子,则最高价氧化物是XO2,故B正确;
C.属于第IVA族元素,在铅元素下方,金属性比铅强,属于金属元素,故C错误;
D.X在铅元素下方,金属性比铅强,属于金属元素,则X的最高价氧化物的水化物显碱性,故D错误.
故选B.
点评 本题考查根据原子结构示意图、原子结构和性质,侧重于同主族元素性质的变化规律的考查,注意判断元素所属周期和族,比较容易.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案
相关题目
15.下列烃中经催化加氢,不能得到2-甲基丁烷的是( )
| A. | 2-甲基-1-丁烯 | B. | 2-甲基-2-丁烯 | ||
| C. | 3-甲基-1-丁炔 | D. | 3,3-二甲基-1-丁炔 |
13.氢气和氯在点燃条件下反应,在反应过程中,断裂1molH2中的化学键消耗的能量为436kJ,断裂1molCl2中的化学键消耗的能量为243kJ,形成1molHCl中的化学键释放的能量为431kJ.请用此数据估计由Cl2、H2生成1mol HCl时的热效应( )
| A. | 放热91.5 kJ | B. | 放热183 kJ | C. | 吸热183 kJ | D. | 吸热91.5 kJ |
20.Te(碲)元素位于是第5周期ⅥA族,根据同族元素的性质推断,碲不可能具有的性质是( )
| A. | Te与H2的反应比S与H2反应困难 | B. | TeO3对应的水化物是一种酸 | ||
| C. | H2Te的还原性比H2S弱 | D. | 有-2、+4、+6三种化合价 |
17.已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9×10-11.某溶液中含有Cl-、Br- 和CrO42-,浓度均为0.010mol/L,向该溶液中逐滴加入0.010mol/L的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
| A. | Cl-、Br-、CrO42- | B. | CrO42-、Br-、Cl- | C. | Br-、Cl-、CrO42- | D. | Br-、CrO42-、Cl- |
14. 中国全运会期间,在济南市等主要街道上,出现了一座座拔地而起的立体花坛,4000万盆、上百种鲜花扮靓了济南街头.大量盆栽鲜花因施用了S-诱抗素制剂,得以保证鲜花盛开,S-诱抗素的分子结构如右图,下列关于该分子的说法正确的是( )
中国全运会期间,在济南市等主要街道上,出现了一座座拔地而起的立体花坛,4000万盆、上百种鲜花扮靓了济南街头.大量盆栽鲜花因施用了S-诱抗素制剂,得以保证鲜花盛开,S-诱抗素的分子结构如右图,下列关于该分子的说法正确的是( )
 中国全运会期间,在济南市等主要街道上,出现了一座座拔地而起的立体花坛,4000万盆、上百种鲜花扮靓了济南街头.大量盆栽鲜花因施用了S-诱抗素制剂,得以保证鲜花盛开,S-诱抗素的分子结构如右图,下列关于该分子的说法正确的是( )
中国全运会期间,在济南市等主要街道上,出现了一座座拔地而起的立体花坛,4000万盆、上百种鲜花扮靓了济南街头.大量盆栽鲜花因施用了S-诱抗素制剂,得以保证鲜花盛开,S-诱抗素的分子结构如右图,下列关于该分子的说法正确的是( )| A. | 1mol该物质与足量的NaOH溶液反应最多消耗2mol NaOH | |
| B. | 该物质在Cu作催化剂条件下能被催化氧化 | |
| C. | 该物质能发生氧化、还原、取代反应 | |
| D. | 分别与足量的Na、NaHCO3 反应生成的气体在相同状况下体积比为2:1 |
15.元素中最高正价与负价绝对值的差等于6的是( )
| A. | N | B. | S | C. | F | D. | Cl |
 实验室用图示装置制取乙酸乙酯.
实验室用图示装置制取乙酸乙酯. 与
与 ⑦CH3CH3与
⑦CH3CH3与