题目内容
16.下列说法正确的是( )| A. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 | |
| B. | 相同浓度和体积的强酸与强碱溶液混合后,溶液的PH=7 | |
| C. | 向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 | |
| D. | 若反应2A(g)+B(g)=2C(g)在一定条件下是一个自发的反应,则该反应为吸热反应 |
分析 A.根据c(H+)=10-(pH)进行计算和判断;
B.等浓度、等体积的强酸和强碱溶液中氢离子、氢氧根离子的物质的量不一定相等;
C.碳酸氢根离子的酸性大于氢氧化铝,二者混合后生成氢氧化铝沉淀和碳酸钠,不会生成气体;
D.根据△G=△H-T•△S可知,反应的自发性与焓变、熵变均有关系.
解答 解:A.pH=4.5的番茄汁中c(H+)=10-4.5mol/L,pH=6.5的牛奶中c(H+)=10-6.5mol/L,则pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍,故A正确;
B.相同浓度和体积的强酸与强碱溶液混合后,混合液中氢离子、氢氧根离子浓度不一定相等,溶液不等于为中性,如等浓度、等体积的盐酸和氢氧化钡溶液混合后,混合液显示碱性,故B错误;
C.偏铝酸钠和碳酸氢钠反应生成氢氧化铝沉淀和碳酸钠,不会生成气体,故C错误;
D.常温下,反应2A(g)+B(g)=2C(g)是熵值减小的反应,△S<0,一定条件下该反应能够自发进行,根据△G=△H-T•△S>0可知,△H必须小于0,该反应一定为放热反应,故D错误.
故选A.
点评 本题考查较为综合,涉及pH的计算、酸碱混合的定性判断、反应的自发进行的判断等知识,综合考查学生的分析能力和化学基本概念的理解和应用能力,为高考常见题型,难度中等,注意掌握溶液酸碱性与溶液pH的关系.

练习册系列答案
相关题目
5.如图所示,隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:3A(g)?xB(g)+xC(g)△H=-192kJ•mol-1,向M、N中都通入3mol A 的气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
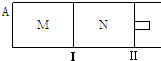

| A. | 若x=2,达到平衡后B 的体积分数关系为:φ(M)>φ(N) | |
| B. | 若x<2,达到平衡后B的转化率关系为:α(M)>α(N) | |
| C. | 若x>2,C的平衡物质的量浓度关系为:c(M)>c(N) | |
| D. | x不论为何值,起始时向N容器中充入任意值的A,平衡后N容器中B的浓度均相等 |
4.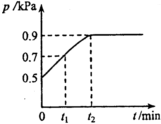 在1.0L密闭容器中放入0.10mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0,容器内气体总压强p随反应时间t的变化关系如图所示.以下分析不正确的是( )
在1.0L密闭容器中放入0.10mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0,容器内气体总压强p随反应时间t的变化关系如图所示.以下分析不正确的是( )
 在1.0L密闭容器中放入0.10mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0,容器内气体总压强p随反应时间t的变化关系如图所示.以下分析不正确的是( )
在1.0L密闭容器中放入0.10mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0,容器内气体总压强p随反应时间t的变化关系如图所示.以下分析不正确的是( )| A. | 从反应开始到t1时的平均反应速率v(X)=$\frac{0.04}{{t}_{1}}$mol(L•min) | |
| B. | 该温度下此反应的平衡常数K=$\frac{0.32}{{t}_{2}}$ | |
| C. | 欲提高平衡体系中Y的含量,可降低体系温度或减少Z的量 | |
| D. | 其他条件不变,再充入0.10 mol气体X,平衡正向移动,X的转化率增大 |
11.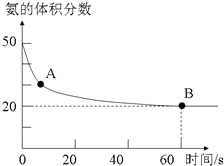 氨气是一种重要的化工原料,在工农业中都有广泛的应用.
氨气是一种重要的化工原料,在工农业中都有广泛的应用.
(1)NH3和CO2在120℃和催化剂的作用下可以合成尿素,反应方程式如下:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g).某实验小组向一个容积不变的真空密闭容器中充入CO2与NH3合成尿素.在恒定温度下,混合气体中NH3的含量随时间的变化关系如图所示(该条件下尿素为固体).A点的正反应速率v正(CO2)大于B点的逆反应速率v逆(CO2)(填“大于”、“小于”或“等于”),NH3的平衡转化率为75%.
(2)氨基甲酸铵(NH2COONH4)是合成尿素过程中的中间产物.现将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生反应并达到平衡:2NH3(g)+CO2(g)?NH2COONH4(s).实验测得在不同温度下的平衡数据如下表:
①上述反应的焓变:△H<0,熵变△S<0(填“>”、“<”或“=”).根据表中数据,列出15.0℃时该反应的化学平衡常数的计算式K=$\frac{1}{(1.6×1{0}^{-3})^{2}×(0.8×1{0}^{-3})}$(不要求计算结果).
②若从已达平衡状态的上述容器中分离出少量的氨基甲酸铵晶体,反应物的转化率将不变(填“增大”、“减小”或“不变”).
(3)向含a mol NH4NO3的溶液中滴加b L氨水后溶液恰好呈中性,则滴加氨水的过程中水的电离平衡将
逆向(填“正向”、“不”或“逆向”)移动,所滴加氨水的浓度为$\frac{a}{200b}$mol•L-1(25℃时,NH3•H2O的电离平衡常数Kb=2×10-5)
 氨气是一种重要的化工原料,在工农业中都有广泛的应用.
氨气是一种重要的化工原料,在工农业中都有广泛的应用.(1)NH3和CO2在120℃和催化剂的作用下可以合成尿素,反应方程式如下:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g).某实验小组向一个容积不变的真空密闭容器中充入CO2与NH3合成尿素.在恒定温度下,混合气体中NH3的含量随时间的变化关系如图所示(该条件下尿素为固体).A点的正反应速率v正(CO2)大于B点的逆反应速率v逆(CO2)(填“大于”、“小于”或“等于”),NH3的平衡转化率为75%.
(2)氨基甲酸铵(NH2COONH4)是合成尿素过程中的中间产物.现将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生反应并达到平衡:2NH3(g)+CO2(g)?NH2COONH4(s).实验测得在不同温度下的平衡数据如下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
②若从已达平衡状态的上述容器中分离出少量的氨基甲酸铵晶体,反应物的转化率将不变(填“增大”、“减小”或“不变”).
(3)向含a mol NH4NO3的溶液中滴加b L氨水后溶液恰好呈中性,则滴加氨水的过程中水的电离平衡将
逆向(填“正向”、“不”或“逆向”)移动,所滴加氨水的浓度为$\frac{a}{200b}$mol•L-1(25℃时,NH3•H2O的电离平衡常数Kb=2×10-5)
1.在理论上不能用于设计原电池的化学反应是 ( )
| A. | NaCl(aq)+AgNO3(aq)=AgCl(s)+NaNO3(aq )△H<0 | |
| B. | 2KMnO4(s)=2K2MnO4(s)+MnO2(s)+O2(g)△H>0 | |
| C. | 2FeCl3(aq)+Fe(s)=3FeCl3(aq)△H<0 | |
| D. | 2H2(g)+O2(g)=2H2O (l)△H<0 |
6.为了确定有机物中是否存在氮、氯、溴、硫等元素,应将有机物样品与下列哪种金属混合熔融后,再无机定性分析( )
| A. | Fe | B. | Si | C. | Cu | D. | Na |
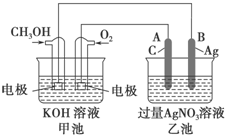 如图是一个化学过程的示意图.已知甲池的总反应式为2CH3OH+3O2+4KOH═2K2CO3+6H2O
如图是一个化学过程的示意图.已知甲池的总反应式为2CH3OH+3O2+4KOH═2K2CO3+6H2O