题目内容
14.已知直链烷烃A比B多一个碳原子,则下列说法正确的是( )| A. | A沸点比B高 | |
| B. | A相对密度比B小 | |
| C. | 一般情况下,同碳原子的烷烃的沸点和密度低于烯烃 | |
| D. | 已知A在常温下为液态,则B不可能为气态 |
分析 直链烷烃A比B多一个碳原子,烷烃中碳原子个数越多其熔沸点越高、密度越大,烷烃的同分异构体中支链越多其熔沸点越低,碳原子小于或等于4的烷烃常温下呈气态,据此分析解答.
解答 解:A.直链烷烃A比B多一个碳原子,烷烃中碳原子个数越多其熔沸点越高、密度越大,A的碳原子个数大于B,所以A的熔沸点高于B,故A正确;
B.直链烷烃A比B多一个碳原子,烷烃中碳原子个数越多其熔沸点越高、密度越大,A的碳原子个数大于B,所以A的密度大于B,故B错误;
C.烷烃、烯烃都属于分子晶体,相对分子质量越大其熔沸点越高,碳原子个数相等时烷烃相对分子质量大于烯烃,所以烷烃熔沸点高于烯烃,故C错误;
D.如果A在常温下为液态,则B可能为气态,如A是戊烷B是丁烷,故D错误;
故选A.
点评 本题考查烷烃熔沸点、密度大小比较,明确烷烃中碳原子个数与物质熔沸点高低关系即可解答,属于基础题,题目难度不大.

练习册系列答案
相关题目
4.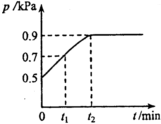 在1.0L密闭容器中放入0.10mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0,容器内气体总压强p随反应时间t的变化关系如图所示.以下分析不正确的是( )
在1.0L密闭容器中放入0.10mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0,容器内气体总压强p随反应时间t的变化关系如图所示.以下分析不正确的是( )
 在1.0L密闭容器中放入0.10mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0,容器内气体总压强p随反应时间t的变化关系如图所示.以下分析不正确的是( )
在1.0L密闭容器中放入0.10mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0,容器内气体总压强p随反应时间t的变化关系如图所示.以下分析不正确的是( )| A. | 从反应开始到t1时的平均反应速率v(X)=$\frac{0.04}{{t}_{1}}$mol(L•min) | |
| B. | 该温度下此反应的平衡常数K=$\frac{0.32}{{t}_{2}}$ | |
| C. | 欲提高平衡体系中Y的含量,可降低体系温度或减少Z的量 | |
| D. | 其他条件不变,再充入0.10 mol气体X,平衡正向移动,X的转化率增大 |
2.下列各组元素中,按最高正化合价递减的顺序排列的是( )
| A. | C、N、Cl | B. | F、O、H | C. | S、P、Si | D. | Na、Mg、Al |
9.某元素R的最高价氧化物对应的水化物是HnRO2n,则在气态氢化物中R元素的化合价是( )
| A. | 3n | B. | 3n-8 | C. | -3n | D. | 8-3n |
19.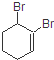 的系统命名的名称是( )
的系统命名的名称是( )
 的系统命名的名称是( )
的系统命名的名称是( )| A. | 1,2-二溴-2-环己烯 | B. | 1,2-二溴-1-环己烯 | ||
| C. | 1,6-二溴-1-环己烯 | D. | 2,3-二溴-1-环己烯 |
6.为了确定有机物中是否存在氮、氯、溴、硫等元素,应将有机物样品与下列哪种金属混合熔融后,再无机定性分析( )
| A. | Fe | B. | Si | C. | Cu | D. | Na |
3.在下列变化过程中,被破坏的作用力正确的是( )
| A. | 干冰升华--共价键 | B. | 二氧化硅熔融--分子间作用力 | ||
| C. | 氢氧化钠熔融--离子键、共价键 | D. | 硫酸氢钠溶于水--离子键、共价键 |
4.运用元素周期律分析下面的推断,其中错误的是( )
| A. | 已知Ra是第七周期、IIA族的元素,故Ra(OH)2的碱性比Mg(OH)2的碱性强 | |
| B. | 已知As是第四周期、VA族的元素,故AsH3 的稳定性比NH3的稳定性强 | |
| C. | 已知Cs原子半径比Na的原子半径大,故Cs与水反应比Na与比反应更剧烈 | |
| D. | 已知Cl与Al处于同一周期,且Cl的核电荷数比Al的核电荷数大,故Cl的原子半径比Al的原子半径小 |