题目内容
1.下列解释事实的离子方程式不正确的是( )| A. | Na放入水中,产生气体:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | FeCl3溶液刻蚀印刷线路板:2Fe3++Cu═2Fe2++Cu2+ | |
| C. | 铜溶于酸化的H2O2溶液:Cu+2H++H2O2═Cu2++2H2O | |
| D. | Al片与少量NaOH溶液反应,产生气体:2Al+2OH-+2H2O═2Al(OH)3+3H2↑ |
分析 A.钠与水反应生成氢氧化钠和氢气;
B.二者反应生成氯化铜和氯化亚铁;
C.铜在酸性条件下被双氧水氧化生成铜离子;
D.反应生成四羟基合铝酸钠.
解答 解:A.Na放入水中,产生气体,离子方程式:2Na+2H2O═2Na++2OH-+H2↑,故A正确;
B.FeCl3溶液刻蚀印刷线路板,离子方程式:2Fe3++Cu═2Fe2++Cu2+,故B正确;
C.铜溶于酸化的H2O2溶液,离子方程式:Cu+2H++H2O2═Cu2++2H2O,故C正确;
D.Al片与少量NaOH溶液反应,产生气体,离子方程式:2Al+2H2O+2OH-═2AlO2-+3H2↑,故D错误;
故选:D.
点评 本题考查了离子反应方程式的书写,明确反应实质是解题关键,注意原子个数守恒、电荷数守恒规律,题目难度不大.

练习册系列答案
相关题目
11.下列装置是从废溴化铝催化剂中制取单质溴并回收氯化铝实验的部分装置,不能达到实验目的是( )
| A. |  用图所示装置氧化Br- | |
| B. | 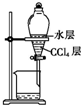 用图所示装置萃取Br2 | |
| C. | 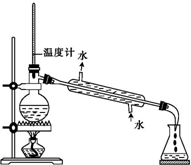 用图所示装置分离CCl4和Br2 | |
| D. | 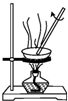 用图所示的装置将含AlCl3的溶液蒸发制取无水AlCl3 |
12.把2.1g CO与H2组成的混合气体与足量的O2充分燃烧后,立即将产物全部通入到足量的Na2O2固体中,则固体的质量增加了( )
| A. | 2.1 g | B. | 3.6 g | C. | 7.2 g | D. | 无法确定 |
16.某些粒子在化学反应中既能体现氧化性又能体现还原性,下列不属于此类的粒子的是( )
| A. | Fe2+ | B. | H2O2 | C. | Mg | D. | S |
6.下列实验能达到目的是( )
| A. | 用Cu与浓硝酸反应制NO2 | |
| B. | 用饱和NaHCO3溶液除去混在Cl2中的HCl气体 | |
| C. | 向AlCl3溶液中加入过量的NaOH溶液以制备Al(OH)3 | |
| D. | 用Cl2除去Fe2(SO4)3溶液中的少量FeSO4 |
13.为了确定(NH4)2Fe(SO4)2•6H2O(硫酸亚铁铵晶体)的成分,下列实验操作及叙述中不正确的是( )
| A. | 取少量样品放入试管中,加热,试管口放一团蘸有无水硫酸铜粉末的棉花团,变蓝则可证明晶体的成分中含有结晶水 | |
| B. | 取少量样品溶于水,向溶液中滴入几滴新制氯水,再滴入2滴KSCN溶液,溶液变为红色,则可证明晶体的成分中含有Fe2+ | |
| C. | 取少量样品溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO42- | |
| D. | 取少量样品放入试管中,加入少量浓NaOH溶液并加热,在试管口用湿润的红色石蕊试纸检验,则可证明晶体的成分中是否含有NH4+ |
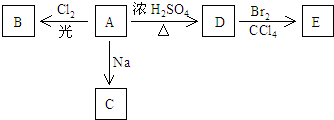
 ;
; ;
;