题目内容
【题目】某地煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)等,一种综合利用工艺设计如下:
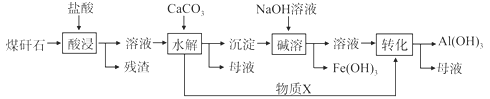
(1)物质X的化学式为__________________
(2)“酸浸”过程中主要反应的离子方程式为:________________,________________
(3)“碱溶”的目的是___________________
(4)从流程中分离出来的Fe(OH)3沉淀可在碱性条件下用KClO溶液处理,制备新型水处理剂高铁酸钾(K2FeO4),该反应的离子方程式为:_________________________
【答案】CO2 Al2O3+6H+=2Al3++3H2O Fe2O3+6H+=2Fe3++3H2O 将Al(OH)3转化为AlO2-,以便和Fe(OH)3分离 2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O
【解析】
含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物用盐酸酸浸发生的反应为:Al2O3+6H+═2Al3++3H2O;Fe2O3+6H+═2Fe3++3H2O;则过滤的溶液为氯化铁和氯化铝的溶液,加碳酸钙消耗溶液中的氢离子使三价铁离子、三价铝离子都水解生成氢氧化铁、氢氧化铝的沉淀,过滤,沉淀中加入氢氧化钠,氢氧化铝溶解反应为:Al(OH)3+OH-═AlO2-+2H2O,所得溶液为偏铝酸钠溶液再通入二氧化碳进一步反应又生成氢氧化铝,所以物质X为CO2。
(1)根据以上分析可知物质X的化学式为CO2;
答案: CO2
(2)由以上分析可知,“酸浸”过程中主要反应的离子方程式为:Al2O3+6H+═2Al3++3H2O;Fe2O3+6H+═2Fe3++3H2O;
答案:Al2O3+6H+=2Al3++3H2O Fe2O3+6H+=2Fe3++3H2O。
(3)沉淀为氢氧化铁、氢氧化铝,过滤,沉淀中加入氢氧化钠,氢氧化铝溶解,与氢氧化铁分离,Al(OH)3+OH-=AlO2-+2H2O;
答案: 将Al(OH)3转化为AlO2-,以便和Fe(OH)3分离
(4)三步法书写离子方程式:①根据化合价升降相等配平化合价发生变化的元素②根据左右两边电荷守恒填写H+或OH-,由于是碱性环境所以填写的是OH③根据所有两边原子守恒填写水。该反应的离子方程式为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;
答案:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O。

 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案