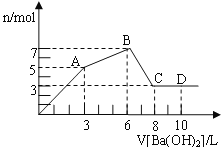
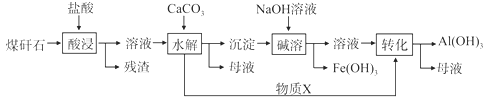
题目内容
【题目】已知五种元素的原子序数的大小顺序为C>A>B>D>E,A,C同周期,B,C同主族。A与B形成的离子化合物A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10个电子的分子。试回答下列问题:
(1)写出五种元素的元素符号:A:________、B:________、C:________、D:________、E:________。
(2)用电子式表示离子化合物A2B的形成过程:______________________。
(3)写出下列物质的电子式:
①D元素形成的单质:_______________________________________________。
②E与B形成的化合物:_____________________________________________。
③A,B,E形成的化合物:___________________________________________。
④D与E形成的化合物:______________________________________________。
⑤C,D,E形成的离子化合物:________________________________________。
【答案】NaOSNH![]()
![]()
![]() 或
或![]()
![]()
![]()
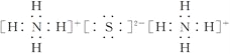 (或
(或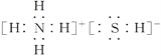 )
)
【解析】
A与B形成离子化合物A2B,A2B中所有离子的电子数相同,且电子总数为30,所以每个离子都有10个电子,由化学式的结构可知,B带2个单位负电荷,A带1个单位正电荷,所以A是Na元素,B是O元素,因为A、C同周期,B与C同主族,所以C为S元素;D和E可形成4核10电子的分子,每个原子平均不到3个电子,可知其中一定含有氢原子,分子中有4个原子核共10个电子,一定是NH3,结合原子序数D>E,可知D是N元素,E是H元素。据此分析可得结论。
(1)由上述分析可知,A为Na,B为O,C为S,D为N,E为H,故答案为:Na;O;S;N;H;
(2)(2)A2B是Na2O,由钠离子与氧离子形成的离子化合物,Na2O的形成过程为![]() ,故答案为:
,故答案为:![]() ;
;
(3)①D元素形成的单质为N2,其电子式为:![]() ,故答案为:
,故答案为:![]() ;
;
②E与B形成的化合物为H2O或H2O2,电子式为:![]() 或
或![]() ,故答案为:
,故答案为:![]() 或
或![]() ;
;
③A、B、E形成的化合物为NaOH,其电子式为:![]() ,故答案为:
,故答案为:![]() ;
;
④D与E形成的化合物为NH3等,NH3电子式为: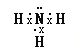 ,故答案为:
,故答案为: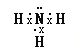 ;
;
⑤C、D、E形成的离子化合物为(NH4)2S或NH4HS,电子式为![]() 或
或![]() ,故答案为:
,故答案为:![]() 或
或![]() 。
。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案【题目】下列除去杂质(试样中括号内的物质是杂质)时,选用的试剂正确的是( )
A | B | C | D | |
试样 | Na2CO3(NaHCO3) | FeCl2(FeCl3) | Fe(Al) | CO2(SO2) |
除杂试剂 | 澄清石灰水 | NaOH溶液 | NaOH溶液 | 饱和NaHSO3溶液 |
A. AB. BC. CD. D