题目内容
【题目】某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O 晶体。(图中夹持及尾气处理装置均已略去)
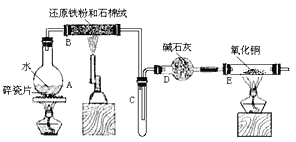
(1)烧瓶底部放置了几片碎瓷片,碎瓷片的作是 ________________。 装置B中发生反应的化学方程式是 ____________________________
(2)如果要在C中玻璃管处点燃该气体,则必须对该气体行________________,装置E中的现象是 _______________________________________
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法 _____________________________。
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
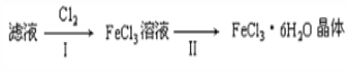
① 步骤I中通入Cl2的作用是__________________________________。
② 步骤II从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:______________________
【答案】防止暴沸 3Fe+4H2O(g) ![]() Fe3O4+4H2。 检验纯度 固体由黑色变为红色,管壁有水珠 取少量滤液,滴入几滴KSCN溶液,观察溶液是否变红色 将滤液中含有的Fe2+氧化成Fe3+ 加热浓缩、冷却结晶、过滤
Fe3O4+4H2。 检验纯度 固体由黑色变为红色,管壁有水珠 取少量滤液,滴入几滴KSCN溶液,观察溶液是否变红色 将滤液中含有的Fe2+氧化成Fe3+ 加热浓缩、冷却结晶、过滤
【解析】
(1)加热液体时可能发生剧烈沸腾,碎瓷片可防止暴沸;B中Fe与水蒸气反应生成四氧化三铁和氢气;
(2)生成氢气具有可燃性,若氢气不纯,点燃时可能发生爆炸,E中氢气还原CuO生成Cu、水;
(3)KSCN溶液遇铁离子为血红色;
(4)滤液中可能含亚铁离子,通入氯气,氯气与亚铁离子反应生成氯化铁。
(1)烧瓶底部放置了几片碎瓷片,碎瓷片的作用是防止暴沸;装置B中发生反应的化学方程式是3Fe+4H2O(g) ![]() Fe3O4+4H2,故答案为:防止暴沸,3Fe+4H2O(g)
Fe3O4+4H2,故答案为:防止暴沸,3Fe+4H2O(g) ![]() Fe3O4+4H2。
Fe3O4+4H2。
(2)如果要在C中玻璃管处点燃氢气,则必须对该气体进行检验纯度,E中氢气还原CuO,观察到的现象为固体由黑色变为红色,管壁有水珠,
故答案为:检验纯度;固体由黑色变为红色,管壁有水珠。
(3)检验滤液中Fe3+的操作方法为取少量滤液,滴入几滴KSCN溶液,观察溶液是否变红色,
故答案为:取少量滤液,滴入几滴KSCN溶液,观察溶液是否变红色。
(4)①因为氯气具有强氧化性,所以能将二价铁离子氧化为三价铁离子,2Fe2++Cl2═2Fe3++2Cl-,
故答案为:将滤液中含有的Fe2+氧化成Fe3+。
②由FeCl3稀溶液得到FeCl36H2O晶体,需加热浓缩、冷却结晶、过滤,
故答案为:加热浓缩、冷却结晶、过滤。