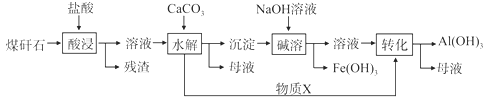
题目内容
【题目】能正确表达下列反应的离子方程式为( )
A. 用稀盐酸除去水垢:2H++CaCO3===Ca2++CO2↑+H2O
B. 硫化亚铁与浓硫酸混合加热:2H++FeS===H2S↑+Fe2+
C. 向硫酸铝溶液中滴加碳酸钠溶液:2Al3++3CO32-===Al2(CO3)3↓
D. Na2O2溶于水产生O2∶Na2O2+H2O===2Na++2OH-+O2↑
【答案】A
【解析】
A.用稀盐酸除去水垢,反应的离子方程式为2H++CaCO3=Ca2++CO2↑+H2O,故A正确;B.硫化亚铁与浓硫酸混合加热,发生氧化还原反应,离子方程式为2FeS+6H2SO4(浓)![]() 2Fe3++3SO42-+3SO2↑+2S+6H2O,故B错误;C.铝离子水解显酸性,碳酸根离子水解显碱性,混合后相互促进水解生成氢氧化铝和二氧化碳,反应的离子方程式为2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑,故C错误;D.Na2O2溶于水产生O2,离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑,故D错误;故选A。
2Fe3++3SO42-+3SO2↑+2S+6H2O,故B错误;C.铝离子水解显酸性,碳酸根离子水解显碱性,混合后相互促进水解生成氢氧化铝和二氧化碳,反应的离子方程式为2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑,故C错误;D.Na2O2溶于水产生O2,离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑,故D错误;故选A。

【题目】某实验小组同学为了探究铜与浓硫酸的反应,进行了如下实验,实验装置如图所示。

实验步骤:
①先连接如图所示的装置,检查好气密性,再加入试剂;
②加热A试管,待B试管中品红溶液退色后,熄灭酒精灯;
③将Cu丝向上抽动离开液面。
请回答下列问题:
(1)A试管中发生反应的化学方程式为____________________________________________。
(2)能够证明铜与浓硫酸反应生成气体的实验现象是_______________________________。
(3)在盛有BaCl2溶液的C试管中,除了导管口有气泡外,无其他明显现象,若将其中的溶液分成两份,分别滴加下列溶液,将产生沉淀的化学式填入表中对应的位置。
滴加的溶液 | 氯水 | 氨水 |
沉淀的化学式 | ________ | ________ |
写出其SO2表现还原性的离子反应方程式:______________________________________。
(4) 装置D的作用__________________________________________________________ 。
(5)实验完毕后,先熄灭酒精灯,由于导管E的存在,试管B中的液体不会倒吸入试管A中,其原因是_________________________________________________________________。