题目内容
2.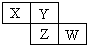 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法正确的是( )| A. | X的气态氢化物比Y的稳定 | |
| B. | W的最高价氧化物对应水化物的酸性比Z的强 | |
| C. | Z的非金属性比Y的强 | |
| D. | Y的氢化物只有一种 |
分析 X、Y、Z、W均为短周期元素,Y原子的最外层电子数是内层电子数的3倍,则Y原子有2个电子层,所以Y为氧元素,根据X、Y、Z、W在周期表中相对位置可知,X为氮元素,Z为硫元素,W为氯元素,结合元素性质的递变规律分析解答.
解答 解:X、Y、Z、W均为短周期元素,Y原子的最外层电子数是内层电子数的3倍,则Y原子有2个电子层,所以Y为氧元素,根据X、Y、Z、W在周期表中相对位置可知,X为氮元素,Z为硫元素,W为氯元素.
A.非金属性越强,气态氢化物越稳定,则非金属性Y>Z,Y的气态氢化物的稳定性较Z的强,故A错误;
B.非金属性越强,最高价氧化物的水化物酸性越强,则非金属性W>Z,最高价氧化物的水化物酸性W较Z强,故B正确;
C.同主族元素从上到下非金属性减弱,则非金属性Y>Z,故C错误;
D.Y为O元素,其氢化物有H2O2、H2O,故D错误,
故选B.
点评 本题考查位置结构性质关系应用,注意掌握元素周期律,理解同主族、同周期元素性质的递变规律.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12. 已知可逆反应:Fe(s)+CO2(g)?FeO(s)+CO(g),其温度与平衡常数K的关系如表:
已知可逆反应:Fe(s)+CO2(g)?FeO(s)+CO(g),其温度与平衡常数K的关系如表:
(1)写出该反应的平衡常数表达式K=$\frac{c(CO{\;}_{2})}{c(CO)}$.
(2)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,改变下列条件再达平衡后判断:
①升高温度,混合气体的平均相对分子质量减小(填“增大、减小或不变”);
②充入氦气,平衡不移动(填“正向移动”、“逆向移动”或“不移动”);
③充入CO2并重新平衡后,混合气体的密度增大(填“增大、减小或不变”).
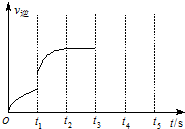
(3)该反应的逆反应速率随时间变化情况如图所示.
①从如图可知,在t1时改变了某种反应条件,使平衡发生移动,反应在t2时达到平衡,改变的条件可能是a(选填编号).
a.升高温度 b.增大CO2的浓度
c.减小CO2的浓度 d.使用催化剂
②如果在t3时增加CO2的量,t4时反应又处于新平衡状态,请在图画出t3~t5时间段的v逆变化曲线.
③下列不能作为判断该反应达到平衡状态的依据是b(选填编号).
a.v正(CO2)=v逆(CO) b.容器内气体总压强不再变化
c.容器内气体质量不再变化 d.混合气体中碳元素的质量分数不再变化.
 已知可逆反应:Fe(s)+CO2(g)?FeO(s)+CO(g),其温度与平衡常数K的关系如表:
已知可逆反应:Fe(s)+CO2(g)?FeO(s)+CO(g),其温度与平衡常数K的关系如表:| T(K) | 938 | 1173 |
| K | 1.47 | 2.15 |
(2)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,改变下列条件再达平衡后判断:
①升高温度,混合气体的平均相对分子质量减小(填“增大、减小或不变”);
②充入氦气,平衡不移动(填“正向移动”、“逆向移动”或“不移动”);
③充入CO2并重新平衡后,混合气体的密度增大(填“增大、减小或不变”).
(3)该反应的逆反应速率随时间变化情况如图所示.
①从如图可知,在t1时改变了某种反应条件,使平衡发生移动,反应在t2时达到平衡,改变的条件可能是a(选填编号).
a.升高温度 b.增大CO2的浓度
c.减小CO2的浓度 d.使用催化剂
②如果在t3时增加CO2的量,t4时反应又处于新平衡状态,请在图画出t3~t5时间段的v逆变化曲线.
③下列不能作为判断该反应达到平衡状态的依据是b(选填编号).
a.v正(CO2)=v逆(CO) b.容器内气体总压强不再变化
c.容器内气体质量不再变化 d.混合气体中碳元素的质量分数不再变化.
7.下列各组物质中,肯定全都属于纯净物的是( )
| A. | 液氯和氯水 | B. | 酒精溶液和乙醇 | ||
| C. | 七水合硫酸亚铁和硫酸亚铁 | D. | 干冰和混有冰的干冰 |
13.下面各组物质中,通入的气体既作氧化剂又作还原剂的是( )
| A. | Cl2通入石灰水中 | B. | CO2通入过氧化钠中 | ||
| C. | NO2通入水中 | D. | SO2通入水中 |
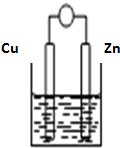 将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如图所示装置.试回答下列问题:
将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如图所示装置.试回答下列问题: 当前环境问题,如酸雨、温室效应、臭氧层破坏、光化学烟雾、有毒物质的污染等,已成为世界各国普遍关注和研究的问题.请回答:
当前环境问题,如酸雨、温室效应、臭氧层破坏、光化学烟雾、有毒物质的污染等,已成为世界各国普遍关注和研究的问题.请回答: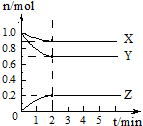 某温度时,在2L容器中X、Y、Z三种物质的物质的量随时间变化曲线如图所示,由图中数据分析,该反应的化学方程式为X+3Y?2Z,反应开始至2min,反应的平均速率v(Z)=0.05mol•L-1•min-1.
某温度时,在2L容器中X、Y、Z三种物质的物质的量随时间变化曲线如图所示,由图中数据分析,该反应的化学方程式为X+3Y?2Z,反应开始至2min,反应的平均速率v(Z)=0.05mol•L-1•min-1. 某化学课外小组用如图装置制取溴苯.
某化学课外小组用如图装置制取溴苯.