题目内容
3.下列方法能达到实验要求的是( )| A. | 用100mL量筒取5.0mL稀硫酸 | |
| B. | 用托盘天平称取2.50gNaCl固体 | |
| C. | 读数时,视线与溶液的凹液面最低点相切 | |
| D. | 在250mL容量瓶中配制240mL0.1mol/LNaOH溶液 |
分析 A.100mL量筒精确到1ml;
B.托盘天平能准确到0.1g;
C.视线与液体的凹液面最低处保持水平;
D.容量瓶只有一个刻度.
解答 解:A.100mL量筒精确到1ml,无法量取5.0mL稀硫酸,故A错误;
B.托盘天平能准确到0.1g,用托盘天平不能称取2.50gNaCl固体,故B错误;
C.读数时,视线与液体的凹液面最低处保持水平,故C正确;
D.容量瓶的规格和所配制的溶液的体积相符,没有240mL的容量瓶,必须采用稍大一点的25mL的容量瓶,故D正确.
故选CD.
点评 本题考查化学实验方案的评价,为高频考点,涉及常用仪器在使用中读数的问题,题目难度不大,注意基础知识的积累.

练习册系列答案
相关题目
11.工业上利用反应3Cl2+2NH3═N2+6HCl检验氯气管道是否漏气.关于该反应,下列说法正确的是( )
| A. | NH3被还原 | B. | Cl2是氧化剂 | ||
| C. | NH3中N的化合价为-3 | D. | 该反应中Cl2表现还原性 |
8.在潜水艇中和防毒面具中也用来消除CO2的是( )
| A. | Na2CO3 | B. | NaOH | C. | Na2O | D. | Na2O2 |
15.下列有关物质性质的比较顺序中,不正确的是( )
| A. | 热稳定性:NH3>PH3>SiH4 | B. | 微粒半径:K+>Na+>Mg2+>Al3+ | ||
| C. | 熔点:Al>Mg | D. | 电负性:F>N>O>C |
12. 已知可逆反应:Fe(s)+CO2(g)?FeO(s)+CO(g),其温度与平衡常数K的关系如表:
已知可逆反应:Fe(s)+CO2(g)?FeO(s)+CO(g),其温度与平衡常数K的关系如表:
(1)写出该反应的平衡常数表达式K=$\frac{c(CO{\;}_{2})}{c(CO)}$.
(2)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,改变下列条件再达平衡后判断:
①升高温度,混合气体的平均相对分子质量减小(填“增大、减小或不变”);
②充入氦气,平衡不移动(填“正向移动”、“逆向移动”或“不移动”);
③充入CO2并重新平衡后,混合气体的密度增大(填“增大、减小或不变”).
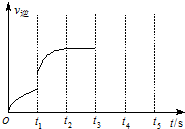
(3)该反应的逆反应速率随时间变化情况如图所示.
①从如图可知,在t1时改变了某种反应条件,使平衡发生移动,反应在t2时达到平衡,改变的条件可能是a(选填编号).
a.升高温度 b.增大CO2的浓度
c.减小CO2的浓度 d.使用催化剂
②如果在t3时增加CO2的量,t4时反应又处于新平衡状态,请在图画出t3~t5时间段的v逆变化曲线.
③下列不能作为判断该反应达到平衡状态的依据是b(选填编号).
a.v正(CO2)=v逆(CO) b.容器内气体总压强不再变化
c.容器内气体质量不再变化 d.混合气体中碳元素的质量分数不再变化.
 已知可逆反应:Fe(s)+CO2(g)?FeO(s)+CO(g),其温度与平衡常数K的关系如表:
已知可逆反应:Fe(s)+CO2(g)?FeO(s)+CO(g),其温度与平衡常数K的关系如表:| T(K) | 938 | 1173 |
| K | 1.47 | 2.15 |
(2)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,改变下列条件再达平衡后判断:
①升高温度,混合气体的平均相对分子质量减小(填“增大、减小或不变”);
②充入氦气,平衡不移动(填“正向移动”、“逆向移动”或“不移动”);
③充入CO2并重新平衡后,混合气体的密度增大(填“增大、减小或不变”).
(3)该反应的逆反应速率随时间变化情况如图所示.
①从如图可知,在t1时改变了某种反应条件,使平衡发生移动,反应在t2时达到平衡,改变的条件可能是a(选填编号).
a.升高温度 b.增大CO2的浓度
c.减小CO2的浓度 d.使用催化剂
②如果在t3时增加CO2的量,t4时反应又处于新平衡状态,请在图画出t3~t5时间段的v逆变化曲线.
③下列不能作为判断该反应达到平衡状态的依据是b(选填编号).
a.v正(CO2)=v逆(CO) b.容器内气体总压强不再变化
c.容器内气体质量不再变化 d.混合气体中碳元素的质量分数不再变化.
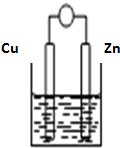 将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如图所示装置.试回答下列问题:
将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如图所示装置.试回答下列问题: