题目内容
一种充电电池放电时的电极反应为H2+2OH—2e-=2H2O;NiO(OH)+H2O+e-=Ni(OH)2+OH-,当为电池充电时,与外电源正极连接的电极上发生的反应是
| A.H2O的还原 | B.NiO(OH)的还原 | C.H2的氧化 | D.NiO(OH) 2的氧化 |
D
解析试题分析:根据题意知,当为电池充电时为电解池,发生的反应为放电时的逆反应,与外电源正极连接的电极是阳极,该极上发生失电子的氧化反应,根据题给电极反应式知,该电极发生的反应为
Ni(OH)2+OH- —e- NiO(OH)+H2O,即Ni(OH)2的氧化,选D。
NiO(OH)+H2O,即Ni(OH)2的氧化,选D。
考点:考查电化学原理。

练习册系列答案
 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
原电池产生电流的本质原因是( )
| A.原电池中溶液能电离出自由移动的离子 |
| B.用导线将两个活动性不同的电极连接 |
| C.正极发生了氧化反应,而负极发生了还原反应 |
| D.电极上进行的氧化还原反应中会有电子的转移 |
下列对钢铁制品采取的措施不能防止或减缓钢铁腐蚀的是( )
| A.保持表面干燥 | B.表面镀锌 |
| C.表面镶嵌铜块 | D.与电源负极相连 |
银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故。根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色会褪去。下列说法正确的是
| A.处理过程中银器一直保持恒重 |
| B.银器为正极,Ag2S被还原生成单质银 |
| C.该过程中总反应为2Al+3Ag2S═6Ag+Al2S3 |
| D.黑色褪去的原因是黑色Ag2S转化为白色AgCl |
我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流。电池总反应为:4Al + 3O2 + 6H2O = 4Al(OH)3,下列说法不正确的是( )
| A.正极反应式为:O2 + 2H2O + 4e- = 4OH- |
| B.电池工作时,电流由铝电极沿导线流向铂电极 |
| C.以网状的铂为正极,可增大与氧气的接触面积 |
| D.该电池通常只需更换铝板就可继续使用 |
储氢合金表面镀铜过程发生反应Cu2++2HCHO+4OH-=Cu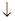 +H2
+H2 +2H2O+2HCOO-,下列说法错误的是
+2H2O+2HCOO-,下列说法错误的是
| A.电镀过程中氢气在镀件表面析出 |
| B.电镀时溶液中Cu2+移向阴极,并在阴极上发生还原反应 |
| C.阳极反应式为HCHO+3OH--2e-=2H2O+HCOO- |
| D.电镀时每生成6.4g铜镀层放出2.24L H2 |
下列各组材料中,不能组成原电池的是 ( )
| | A | B | C | D |
| 两极材料 | Zn片、石墨 | Cu片、Ag片 | Zn片、Cu片 | Fe片、Cu片 |
| 插入溶液 | 硫酸溶液 | 硝酸银溶液 | 蔗糖溶液 | 稀盐酸 |