题目内容
银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故。根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色会褪去。下列说法正确的是
| A.处理过程中银器一直保持恒重 |
| B.银器为正极,Ag2S被还原生成单质银 |
| C.该过程中总反应为2Al+3Ag2S═6Ag+Al2S3 |
| D.黑色褪去的原因是黑色Ag2S转化为白色AgCl |
B
解析试题分析:A.银器放在铝制容器中,由于铝的活泼性大于银,故铝为负极,失电子,银为正极,银表面的Ag2S得电子,析出单质银,所以银器质量减小,故A错误;B.黑色褪去是Ag2S转化为Ag而不是AgCl,故B错误;C.Al2S3在溶液中不能存在,会发生双水解反应生成H2S和Al(OH)3,故C错误;D.银作正极,正极上Ag2S得电子作氧化剂,在反应中被还原生成单质银,故D正确;故选D。
考点:考查原电池原理。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列事实与电化学腐蚀无关的是
| A.生铁比纯铁易生锈 |
| B.黄铜(铜锌合金)制品不易产生铜绿 |
| C.纯银饰品久置表面变暗 |
| D.与铜管连接的铁管易生锈 |
铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如下。
下列说法不正确的是
| A.因铁的金属性比铜强,所以铁铆钉被氧化而腐蚀 |
| B.若水膜中溶解了SO2,则铁铆钉腐蚀的速率变小 |
| C.铜极上的反应是2H+ + 2e- ="=" H2↑,O2 + 4e- + 4H+ ="=" 2H2O |
| D.在金属表面涂一层油脂,能防止铁铆钉被腐蚀 |
一种充电电池放电时的电极反应为H2+2OH—2e-=2H2O;NiO(OH)+H2O+e-=Ni(OH)2+OH-,当为电池充电时,与外电源正极连接的电极上发生的反应是
| A.H2O的还原 | B.NiO(OH)的还原 | C.H2的氧化 | D.NiO(OH) 2的氧化 |
将锌片和铜片按图示方式插入柠檬中,电流计指针发生偏转。下列针对该装置的说法正确的是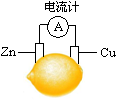
| A.将电能转化为化学能 |
| B.电子由铜片流出 |
| C.锌片是负极. |
| D.铜片逐渐被腐蚀 |
下列关于下图所示原电池装置的叙述中,正确的是
| A.铜片是负极 |
| B.铜片质量逐渐减少 |
| C.电流从锌片经导线流向铜片 |
| D.氢离子在铜片表面被还原 |
某燃料电池的装置如下图所示,在工作中石墨A电极反应生成一种氧化物Y,下列说法正确的是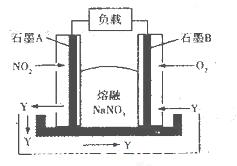
| A.石墨A极为正极,石墨B极为负极 |
| B.Y的化学式可能为NO |
| C.石墨B极上发生氧化反应 |
D.石墨A极的电极反应式为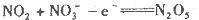 |
下列叙述正确的是
| A.电解饱和食盐水制烧碱采用离子交换膜法,可以阻止阳离子通过 |
| B.在铁上镀锌时,锌棒作阴极,且电解液硫酸锌的浓度是不变的 |
| C.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1: 2 |
| D.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH |
铅蓄电池在现代生活中有广泛应用,其电极材料是Pb 和PbO2,电解液是H2SO4溶液。现用铅蓄电池电解饱和硫酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法不正确的是
| A.蓄电池放电时,电路中每转移2 mol电子,最多有1 molPbO2被还原 |
| B.电解池的阳极反应式为:4OH--4e-=2H2O+O2↑ |
| C.电解后, c(Na2SO4)不变,且溶液中有晶体析出 |
| D.蓄电池中每生成1mol H2O,电解池中就消耗1mol H2O |