题目内容
下列装置能够组成原电池是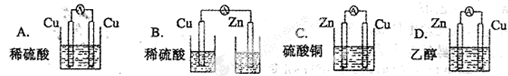
C
解析试题分析:A.两个电极材料相同,不能构成原电池,错误;B.不能构成闭合回路,错误;C.具备构成原电池的条件,正确;C.乙醇是非电解质,没有电解质溶液,不具备构成原电池的条件,错误。
考点:考查原电池的构成条件的知识。

练习册系列答案
相关题目
随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气,分别通入一个加热到570℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如图)。下列有关说法中正确的是 
| A.电解法合成氨的电解池中能用水作电解质溶液的溶剂 |
| B.钯电极B连接的是电源的负极 |
| C.钯电极A的电极反应式为:N2+6e—+6H+==2NH3 |
| D.当有0.3mol电子转移时,有2.688L NH3生成 |
用惰性电极电解下列溶液,在阴、阳两极生成气体的体积比为1∶1的是( )
A. 溶液 溶液 | B. 溶液 溶液 | C.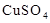 溶液 溶液 | D.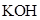 溶液 溶液 |
用惰性电极电解下列溶液,起始时在阳极上不能生成O2的是( )
| A.KNO3 | B.Na2S | C.Ba(OH)2 | D.H2SO4 |
将纯锌片和纯铜片按图方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是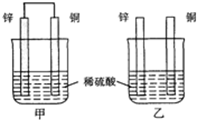
| A.两烧杯中溶液的pH均增大 |
| B.甲中铜片是正极,乙中铜片是负极 |
| C.两烧杯中铜片表面均无气泡产生 |
| D.甲、乙溶液均变蓝色 |
某金属元素R的硝酸盐R(NO3)n溶液用Pt电极电解,阳极产生气体V L(标准状况)时,阴极质量增加m g,若R的原子量为M,下列叙述中不正确的是 ( )
A.电路中通过电子 mol mol | B.n=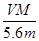 |
C.溶液中H+增加 mol mol | D.n= |
一种充电电池放电时的电极反应为H2+2OH—2e-=2H2O;NiO(OH)+H2O+e-=Ni(OH)2+OH-,当为电池充电时,与外电源正极连接的电极上发生的反应是
| A.H2O的还原 | B.NiO(OH)的还原 | C.H2的氧化 | D.NiO(OH) 2的氧化 |
钛被称为21世纪金属。研究发现,用石墨作阳极、钛网作阴极、熔融CaF2—CaO作电解质,利用图所示装置制备金属钛。下列叙述正确的是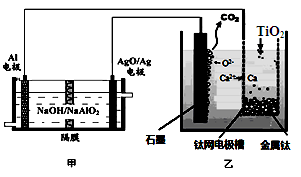
| A.乙装置阴极的电极反应式为 TiO2+4e-=Ti+2O2- |
| B.若不考虑能量的损失,制备24.0g 金属钛,需要消耗金属铝36.0g |
| C.甲装置工作过程中OH-向AgO/Ag极移动;乙装置工作过程中O2-向钛网移动 |
| D.乙装置中的石墨电极需要定期更换 |
下列叙述正确的是
| A.电解饱和食盐水制烧碱采用离子交换膜法,可以阻止阳离子通过 |
| B.在铁上镀锌时,锌棒作阴极,且电解液硫酸锌的浓度是不变的 |
| C.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1: 2 |
| D.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH |