题目内容
下列对钢铁制品采取的措施不能防止或减缓钢铁腐蚀的是( )
| A.保持表面干燥 | B.表面镀锌 |
| C.表面镶嵌铜块 | D.与电源负极相连 |
C
解析试题分析:A、保持钢铁制品表面干燥,使金属不和水接触,能防止或减缓钢铁腐蚀,错误;B、在钢铁制品表面镀锌,采用的是牺牲阳极保护法,能防止或减缓钢铁腐蚀,错误;C、在钢铁制品表面镶嵌铜块,形成的原电池中,金属铁做负极,可以加快腐蚀速率,不能防止或减缓钢铁腐蚀,正确;D、将钢铁制品与电源负极相连,采用的是阴极电保护法,能防止或减缓钢铁腐蚀,错误。
考点:考查金属的腐蚀与防护。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
蓄电池在放电时起原电池作用,在充电时起电解池作用。下面是爱迪生蓄电池分别在充电和放电时发生的反应:Fe+NiO2+2H2O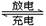 Fe(OH)2+Ni(OH)2。下列有关爱迪生蓄电池的说法正确的是
Fe(OH)2+Ni(OH)2。下列有关爱迪生蓄电池的说法正确的是
| A.放电时,Fe是负极,发生还原反应,NiO2是正极,发生氧化反应 |
| B.蓄电池的电极可以浸入某种酸性电解质溶液中 |
| C.放电时,电解质溶液中的阴离子向正极方向移动 |
| D.充电时,阴极上的电极反应式为:Fe(OH)2+2e-=Fe+2OH- |
用惰性电极电解下列溶液,起始时在阳极上不能生成O2的是( )
| A.KNO3 | B.Na2S | C.Ba(OH)2 | D.H2SO4 |
某金属元素R的硝酸盐R(NO3)n溶液用Pt电极电解,阳极产生气体V L(标准状况)时,阴极质量增加m g,若R的原子量为M,下列叙述中不正确的是 ( )
A.电路中通过电子 mol mol | B.n=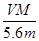 |
C.溶液中H+增加 mol mol | D.n= |
铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如下。
下列说法不正确的是
| A.因铁的金属性比铜强,所以铁铆钉被氧化而腐蚀 |
| B.若水膜中溶解了SO2,则铁铆钉腐蚀的速率变小 |
| C.铜极上的反应是2H+ + 2e- ="=" H2↑,O2 + 4e- + 4H+ ="=" 2H2O |
| D.在金属表面涂一层油脂,能防止铁铆钉被腐蚀 |
一种充电电池放电时的电极反应为H2+2OH—2e-=2H2O;NiO(OH)+H2O+e-=Ni(OH)2+OH-,当为电池充电时,与外电源正极连接的电极上发生的反应是
| A.H2O的还原 | B.NiO(OH)的还原 | C.H2的氧化 | D.NiO(OH) 2的氧化 |
下列关于下图所示原电池装置的叙述中,正确的是
| A.铜片是负极 |
| B.铜片质量逐渐减少 |
| C.电流从锌片经导线流向铜片 |
| D.氢离子在铜片表面被还原 |
某同学组装了如图所示的电化学装置电极I为Al,其他电极均为Cu,则
A.电流方向:电极IV→ →电极I →电极I |
| B.电极I发生还原反应 |
| C.电极II逐渐溶解 |
| D.电极III的电极反应:Cu2++2e-==Cu |
下列叙述正确的是
| A.电解饱和食盐水制烧碱采用离子交换膜法,可以阻止阳离子通过 |
| B.在铁上镀锌时,锌棒作阴极,且电解液硫酸锌的浓度是不变的 |
| C.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1: 2 |
| D.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH |