题目内容
10.下列分子中的键的极性最强的是( )| A. | H2O | B. | NH3 | C. | HF | D. | HCl |
分析 形成共用电子对的两元素的非金属性强弱相差越大,共价键的极性越强,选项中都是H原子分别与O、N、F、Cl原子形成的极性键,可以根据与O、N、F、Cl的非金属性判断键的极性最强.
解答 解:由于形成共用电子对的两元素的非金属性强弱相差越大,形成的共价键的极性越强;选项中都是H原子分别与O、N、F、Cl原子形成的极性键,可以根据O、N、F、Cl的非金属性判断键的极性强弱.而这四种元素中非金属性最强的是F,所以极性键的极性最强的为HF,
故选C.
点评 本题考查了键的极性强弱判断,题目难度不大,侧重对学生灵活运用基础知识解决实际问题的能力的培养,注意形成共用电子对的两元素的非金属性强弱相差越大,共价键的极性越强.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
1. 某实验小组配制0.10mol/L NaOH溶液并进行有关性质实验,回答下列问题.
某实验小组配制0.10mol/L NaOH溶液并进行有关性质实验,回答下列问题.
(1)若实验中大约要使用475mL NaOH溶液,至少需要称量NaOH固体2.0g.
(2)从图中选择称量NaOH固体所需要的仪器是(填字母)abe.
(3)下列情况会使所配溶液浓度偏低的是(填序号)①③⑤⑥
①称量时,左盘高,右盘低
②固体溶解后未冷却到室温就直接转移到容量瓶中
③溶液转移到容量瓶后,未进行洗涤操作
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,仰视容量瓶的刻度线
⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度实验室欲配制
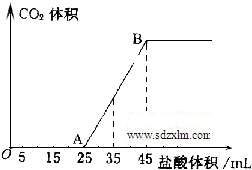
(4)向VmL上述浓度的NaOH溶液中,通入一定量的CO2后,然后向该溶液中逐滴加入1mol.L-1的盐酸,所加入盐酸溶液的体积与产生CO2的体积关系如图所示:
①当加入35.0mL盐酸溶液时,产生标准状况下二氧化碳的体积为224mL;
②计算所取氢氧化钠溶液的体积V=450mL.
(5)取上述氢氧化钠溶液200mL,加入适量铝粉使之恰好完全反应,该反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,逐渐向反应后的溶液中至少加入1.0mol.L-1的盐酸80 mL才能使生成的沉淀完全溶解.
 某实验小组配制0.10mol/L NaOH溶液并进行有关性质实验,回答下列问题.
某实验小组配制0.10mol/L NaOH溶液并进行有关性质实验,回答下列问题.(1)若实验中大约要使用475mL NaOH溶液,至少需要称量NaOH固体2.0g.
(2)从图中选择称量NaOH固体所需要的仪器是(填字母)abe.
| 名称 | 托盘天平 (带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
①称量时,左盘高,右盘低
②固体溶解后未冷却到室温就直接转移到容量瓶中
③溶液转移到容量瓶后,未进行洗涤操作
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,仰视容量瓶的刻度线
⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度实验室欲配制
(4)向VmL上述浓度的NaOH溶液中,通入一定量的CO2后,然后向该溶液中逐滴加入1mol.L-1的盐酸,所加入盐酸溶液的体积与产生CO2的体积关系如图所示:
①当加入35.0mL盐酸溶液时,产生标准状况下二氧化碳的体积为224mL;
②计算所取氢氧化钠溶液的体积V=450mL.
(5)取上述氢氧化钠溶液200mL,加入适量铝粉使之恰好完全反应,该反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,逐渐向反应后的溶液中至少加入1.0mol.L-1的盐酸80 mL才能使生成的沉淀完全溶解.
18.选用适当的催化剂是改变反应速率常用的有效方法之一.某实验小组以H2O2分解为例,探究Fe3+和Cu2+对H2O2分解的催化效果.
仪器任选.限选试剂:5% H2O2溶液、胆矾晶体、0.05mol/L Fe2(SO4)3溶液、0.1mol/L Fe2(SO4)3溶液、0.1mol/L Na2SO4溶液、蒸馏水.
Ⅰ.配制100mL 0.1 mol/LCuSO4溶液
(1)需用托盘天平称取2.5g胆矾晶体,溶解胆矾晶体时需要的玻璃仪器是烧杯和玻璃棒.
(2)如图是实验小组配制100mL 0.1mol/LCuSO4溶液过程中定容操作的示意图,该操作的错误之处未用胶头滴管定容、定容时应平视液面.
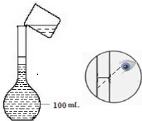
(3)若其他操作均正确,按照图示观察方法定容,所配溶液浓度偏高.(填“偏高”或“偏低”)
Ⅱ.探究Fe3+和Cu2+对H2O2分解的催化效果
实验小组用右下图所示装置,选取相关试剂,设计并进行以下实验.忽略其他因素的影响,实验中相关数据记录如下表:
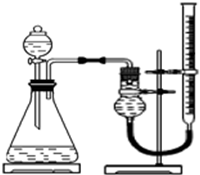
(4)除上述装置中的仪器及量筒外,还要用到的计量工具是秒表.为确保实验的准确性,实验前需检查该装置的气密性,操作是关闭分液漏斗活塞,向右端滴定管中加水,如果一段时间后,滴定管中液面不再下降,说明气密性良好..
(5)实验①④的主要目的是排除SO42-对双氧水分解速率的影响.
(6)实验②中选用试剂的体积v1=5mL.
(7)实验③中选用的试剂M是0.05mol/LFe2(SO4)3溶液;若正确选用试剂进行实验,测得收集V mL O2所需时间m>n>p,由此得出的实验结论是Fe3+和Cu2+对H2O2分解均有催化作用,但Fe3+的催化效果更好.
仪器任选.限选试剂:5% H2O2溶液、胆矾晶体、0.05mol/L Fe2(SO4)3溶液、0.1mol/L Fe2(SO4)3溶液、0.1mol/L Na2SO4溶液、蒸馏水.
Ⅰ.配制100mL 0.1 mol/LCuSO4溶液
(1)需用托盘天平称取2.5g胆矾晶体,溶解胆矾晶体时需要的玻璃仪器是烧杯和玻璃棒.
(2)如图是实验小组配制100mL 0.1mol/LCuSO4溶液过程中定容操作的示意图,该操作的错误之处未用胶头滴管定容、定容时应平视液面.

(3)若其他操作均正确,按照图示观察方法定容,所配溶液浓度偏高.(填“偏高”或“偏低”)
Ⅱ.探究Fe3+和Cu2+对H2O2分解的催化效果
实验小组用右下图所示装置,选取相关试剂,设计并进行以下实验.忽略其他因素的影响,实验中相关数据记录如下表:
| 实验序号 | 5% H2O2溶液的体积(mL) | 选用试剂 | 选用试剂体积(mL) | 收集V mL O2所需时间(min) |
| ① | 10 | 蒸馏水 | 5 | m |
| ② | 10 | 0.1mol/L CuSO4 | v1 | n |
| ③ | 10 | 试剂M | 5 | p |
| ④ | 10 | 0.1mol/L Na2SO4 | 5 | m |

(4)除上述装置中的仪器及量筒外,还要用到的计量工具是秒表.为确保实验的准确性,实验前需检查该装置的气密性,操作是关闭分液漏斗活塞,向右端滴定管中加水,如果一段时间后,滴定管中液面不再下降,说明气密性良好..
(5)实验①④的主要目的是排除SO42-对双氧水分解速率的影响.
(6)实验②中选用试剂的体积v1=5mL.
(7)实验③中选用的试剂M是0.05mol/LFe2(SO4)3溶液;若正确选用试剂进行实验,测得收集V mL O2所需时间m>n>p,由此得出的实验结论是Fe3+和Cu2+对H2O2分解均有催化作用,但Fe3+的催化效果更好.
5.下列除杂方法不合理的是( )
| A. | 通过饱和食盐水除去Cl2中的HCl | |
| B. | 通过NaOH溶液除去CO2中的HCl | |
| C. | 通过加热法除去Na2CO3固体中的NaHCO3 | |
| D. | 通过NaOH溶液除去CO中混有的CO2 |
2.配制500mL 0.1mol/L的硫酸铜溶液,需用胆矾(CuSO4•5H2O)( )
| A. | 8.00g | B. | 16.0g | C. | 25.0g | D. | 12.5g |
19.化学与社会、环境、生活有密切联系,下列说法错误的是( )
| A. | 树立“同呼吸、共奋斗”的行为推测,倡导节约、绿色消费方式和生活习惯 | |
| B. | 用浸泡过的高锰酸钾的硅藻土来吸收香蕉产生的乙烯,达到保鲜的目的 | |
| C. | 手机外壳上贴的碳纤维外膜是一种新型有机高分子材料 | |
| D. | 雾霾天气的形成与机动车辆猛增和尾气超标有关 |
 某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:
某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析: 2Z
2Z