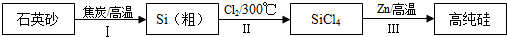题目内容
8.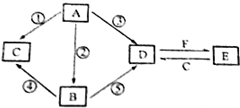 A、B、C、D、E五种物质所含元素均有两种相同,且焰色反应均为黄色,B比A相对更稳定,C、D是工业上重要的化工原料,也是实验室常用的药品,C、D在一定的条件下可以相互转化,F与A、B、C、D在一定条件下均可发生反应,它们的部分转化关系如图(部分反应物或生成物省略).
A、B、C、D、E五种物质所含元素均有两种相同,且焰色反应均为黄色,B比A相对更稳定,C、D是工业上重要的化工原料,也是实验室常用的药品,C、D在一定的条件下可以相互转化,F与A、B、C、D在一定条件下均可发生反应,它们的部分转化关系如图(部分反应物或生成物省略).(1)B的电子式
 ,C的俗名为火碱或烧碱;
,C的俗名为火碱或烧碱;(2)在①②③④⑤中,属于氧化还原反应的是②④⑤,属于化合反应的是①②③.
分析 A、B、C、D、E五种物质所含元素均有两种相同,且焰色反应均为黄色,说明都含有钠元素,根据中学常见含钠物质,A、B、C、D、E应Na2O、Na2O2、Na2CO3、NaHCO3、NaOH中选择,C、D是工业上重要的化工原料,也是实验室常用的药品,C、D在一定的条件下可以相互转化,则C、D应为碳酸钠和氢氧化钠,B比A相对更稳定,根据转化关系,A、B都可以生成C、D,且A能生成B,则A为Na2O,B为Na2O2,C、D在一定的条件下可以相互转化,F与A、B、C、D在一定条件下均可发生反应,则F应为CO2,根据D与F生成E,E与C生成D可知,D为Na2CO3,E为NaHCO3,C为NaOH,据此答题;
解答 解:A、B、C、D、E五种物质所含元素均有两种相同,且焰色反应均为黄色,说明都含有钠元素,根据中学常见含钠物质,A、B、C、D、E应Na2O、Na2O2、Na2CO3、NaHCO3、NaOH中选择,C、D是工业上重要的化工原料,也是实验室常用的药品,C、D在一定的条件下可以相互转化,则C、D应为碳酸钠和氢氧化钠,B比A相对更稳定,根据转化关系,A、B都可以生成C、D,且A能生成B,则A为Na2O,B为Na2O2,C、D在一定的条件下可以相互转化,F与A、B、C、D在一定条件下均可发生反应,则F应为CO2,根据D与F生成E,E与C生成D可知,D为Na2CO3,E为NaHCO3,C为NaOH,
(1)B为Na2O2,B的电子式为  ,C为NaOH,C的俗名为 火碱或烧碱,
,C为NaOH,C的俗名为 火碱或烧碱,
故答案为: ;火碱或烧碱;
;火碱或烧碱;
(2)在①②③④⑤中,反应①为氧化钠与水生成氢氧化钠的反应为非氧化还原反应,是化合反应,反应②为氧化钠与氧气生成过氧化钠,是氧化还原反应,也是化合反应,反应③为氧化钠与二氧化碳生成碳酸钠的反应是非氧化还原反应,是化合反应,反应④为过氧化钠与水反应生成氢氧化钠,是氧化还原反应,反应⑤是过氧化钠与二氧化碳生成碳酸钠的反应,是氧化还原反应,所以属于氧化还原反应的是②④⑤,属于化合反应的是①②③,
故答案为:②④⑤;①②③.
点评 本题考查了物质的性质及物质间的转化,正确推断物质是解本题关键,注意某些物质的特殊性质,难度中等.

 阅读快车系列答案
阅读快车系列答案仪器任选.限选试剂:5% H2O2溶液、胆矾晶体、0.05mol/L Fe2(SO4)3溶液、0.1mol/L Fe2(SO4)3溶液、0.1mol/L Na2SO4溶液、蒸馏水.
Ⅰ.配制100mL 0.1 mol/LCuSO4溶液
(1)需用托盘天平称取2.5g胆矾晶体,溶解胆矾晶体时需要的玻璃仪器是烧杯和玻璃棒.
(2)如图是实验小组配制100mL 0.1mol/LCuSO4溶液过程中定容操作的示意图,该操作的错误之处未用胶头滴管定容、定容时应平视液面.
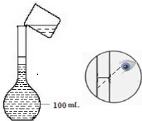
(3)若其他操作均正确,按照图示观察方法定容,所配溶液浓度偏高.(填“偏高”或“偏低”)
Ⅱ.探究Fe3+和Cu2+对H2O2分解的催化效果
实验小组用右下图所示装置,选取相关试剂,设计并进行以下实验.忽略其他因素的影响,实验中相关数据记录如下表:
| 实验序号 | 5% H2O2溶液的体积(mL) | 选用试剂 | 选用试剂体积(mL) | 收集V mL O2所需时间(min) |
| ① | 10 | 蒸馏水 | 5 | m |
| ② | 10 | 0.1mol/L CuSO4 | v1 | n |
| ③ | 10 | 试剂M | 5 | p |
| ④ | 10 | 0.1mol/L Na2SO4 | 5 | m |
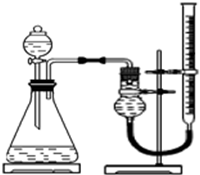
(4)除上述装置中的仪器及量筒外,还要用到的计量工具是秒表.为确保实验的准确性,实验前需检查该装置的气密性,操作是关闭分液漏斗活塞,向右端滴定管中加水,如果一段时间后,滴定管中液面不再下降,说明气密性良好..
(5)实验①④的主要目的是排除SO42-对双氧水分解速率的影响.
(6)实验②中选用试剂的体积v1=5mL.
(7)实验③中选用的试剂M是0.05mol/LFe2(SO4)3溶液;若正确选用试剂进行实验,测得收集V mL O2所需时间m>n>p,由此得出的实验结论是Fe3+和Cu2+对H2O2分解均有催化作用,但Fe3+的催化效果更好.
| A. | 树立“同呼吸、共奋斗”的行为推测,倡导节约、绿色消费方式和生活习惯 | |
| B. | 用浸泡过的高锰酸钾的硅藻土来吸收香蕉产生的乙烯,达到保鲜的目的 | |
| C. | 手机外壳上贴的碳纤维外膜是一种新型有机高分子材料 | |
| D. | 雾霾天气的形成与机动车辆猛增和尾气超标有关 |
| A. | 11 | B. | 22 | C. | 44 | D. | 77 |
| 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
| A | Na2CO3 | H2SO4 | NaOH | SO2 | CO2 |
| B | NaOH | HCl | NaCl | Na2O | CO2 |
| C | NaOH | CH3COOH | CaF2 | CO | SO2 |
| D | KOH | HNO3 | CaCO3 | CaO | SO2 |
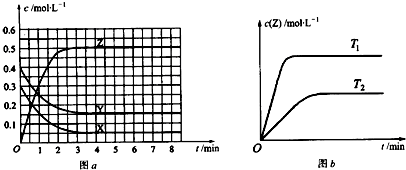
| A. | 该反应的化学方程式为:X+Y?2Z | |
| B. | 当反应速率大小关系为:v(X)=v(Y)=2v(Z)时,该反应达到平衡状态 | |
| C. | 图a中反应达到平衡时,Y的转化率为37.5% | |
| D. | 该反应的正反应是放热反应 |
 某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:
某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析: 2Z
2Z