题目内容
1.下列说法中,正确的是( )| A. | 热化学方程式中的化学计量数表示物质的量,可以是分数 | |
| B. | △H>0 kJ•mol-1表示放热反应,△H<0 kJ•mol-1表示吸热反应 | |
| C. | 1 mol H2SO4与1 molBa(OH)2反应生成H2O时放出的热叫做中和热 | |
| D. | 1 mol H2与0.5 molO2反应放出的热就是H2的燃烧热 |
分析 A.热化学方程式中的化学计量数表示物质的量,能为分数;
B.△H>0表示吸热反应,△H<0表示放热反应;
C.中和热是强酸强碱的稀溶液完全反应生成1mol水放出的热量分析;
D.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量.
解答 解:A.热化学方程式中的化学计量数表示物质的量,不表示分子数,所以能为分数,故A正确;
B.△H>0表示吸热反应,△H<0表示放热反应,故B错误;
C.1 mol H2SO4与1 molBa(OH)2反应生成2molH2O,且生成硫酸钡沉淀放出热量,所以此时放出的热不叫做中和热,故C错误;
D.1 mol H2与0.5 mol O2反应生成液态水放出的热就是H2的燃烧热,故D错误;
故选A.
点评 本题考查了反应焓变的计算判断,燃烧热概念的分析应用,热化学方程式的表示意义,题目较简单.

 阅读快车系列答案
阅读快车系列答案| A. | v(H2)=0.015mol/(L•min) | B. | v(N2)=0.02mol/(L•min) | ||
| C. | v(NH3)=0.17mol/(L•min) | D. | v(NH3)=0.02mol/(L•min) |
| A. | $\frac{MV}{22.4(V+0.1)d}$ | B. | $\frac{1000VdM}{MV+2240}$ | C. | $\frac{1000Vd}{MV+2240}$ | D. | $\frac{Vd}{MV+2240}$ |
| A. | 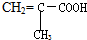 | B. | 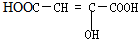 | C. | HCOOCH=CHCOOH | D. | CH2=C-COOCH3 |
| A. | 基态原子含有未成对电子最多的第二周期元素 | |
| B. | 某激发态为1s22s12p3的原子 | |
| C. | 基态原子最外层电子排布为2s22p6的元素 | |
| D. | 基态原子最外层电子排布为3s23p5的元素 |
| A. | 124 g P4含有P-P键的个数为4NA | |
| B. | 12 g石墨中含有C-C键的个数为1.5NA | |
| C. | 12 g金刚石中含有C-C键的个数为4NA | |
| D. | 60gSiO2中含Si-O键的个数为2NA |
甲、乙两个小组利用酸性KMnO4与H2C2O4溶液反应,设计实验探究影响反应速率的因素(2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2+8H2O)
甲组:利用如图装置,通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小.(实验中所用KMnO4溶液均已加入H2SO4)

序号 | A溶液 | B溶液 |
① | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
② | 2ml 0.1mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
③ | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液和少量MnSO4 |
(1)该实验的目的是探究________________对化学反应速率的影响.
(2)分液漏斗中A溶液应该_____________加入(填“一次性”或“逐滴滴加”)
(3)实验结束后,读数前为了使两个量气管的压强相等,避免产生压强差,影响测定结果,需要进行的操作是____________________.
乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率为了探究KMnO4与H2C2O4浓度对反应速率的影响,某同学在室温下完成以下实验
实验编号 | 1 | 2 | 3 | 4 |
水/ml | 10 | 5 | 0 | X |
0.5mol/L H2C2O4/ml | 5 | 10 | 10 | 5 |
0.2mol/L KMnO4/ml | 5 | 5 | 10 | 10 |
时间/s | 40 | 20 | 10 | ﹣﹣﹣ |
(4)X=____________
A.5 B.10 C.15 D.20
4号实验中始终没有观察到溶液褪色,你认为可能的原因是____________