题目内容
6.现有室温下浓度均为1×10-3mol/L的几种溶液:①盐酸、②硫酸、③醋酸、④氯化铵、⑤氨水、⑥NaOH溶液,回答下列问题:(1)将③、⑥混合后,若溶液呈中性,则消耗两溶液的体积为③>⑥(填“>”、“<”或“=”).溶液中的离子浓度由大到小的顺序为C(Na+)=C(CH3COO-)>C(OH-)=C(H+).
(2)将等体积的①、⑤混合,则溶液的pH<7(填“>”、“<”或“=”),用离子方程式说明其原因NH4++H2O?NH3•H2O+H+.
(3)向相同体积的①、②、③溶液中分别加入相同的且足量的锌粒,反应的初始速率由快到慢的顺序为②①③,最终产生H2总量的关系为②>①=③;
(4)向相同体积的①、③溶液中分别加入相同浓度、相同体积的CH3COONa溶液,充分混合后,混合液的pH大小关系为①<③(填“>”、“<”或“=”)
(5)若将等体积的⑤、⑥溶液加热至相同温度后,溶液的pH⑤<⑥(填“>”、“<”或“=”)
分析 (1)③醋酸、⑥NaOH溶液混合,溶液呈中性,依据醋酸是弱酸分析,同体积溶液混合溶液呈碱性,若溶液呈中性需要酸稍过量;依据溶液中电荷守恒比较氯离子浓度大小比较;
(2)将等体积的①盐酸、⑤氨水混合,溶液浓度相同,恰好反应生成氯化铵溶液,铵根离子水解显酸性;
(3)向相同体积的:①盐酸、②硫酸、③醋酸溶液中分别加入相同的且足量的锌粒,浓度均为1×10-3mol/L溶质物质的量相同,溶液中氢离子浓度②>①>③;产生氢气②>①═③;
(4)向相同体积的①盐酸、③醋酸溶液中分别加入相同浓度、相同体积的CH3COONa溶液,①中和盐酸恰好完全反应生成醋酸和氯化钠,②中醋酸根离子对醋酸电离起到抑制作用,氢离子浓度减小;
(5)若将等体积、等浓度的⑤氨水、⑥NaOH溶液,氨水中的溶质是弱碱存在电离平衡,溶液PH⑥>⑤;溶液加热至相同温度后,⑤溶液电离促进,氢氧根离子浓度增大,但不能完全电离;⑥溶液中离子积增大,氢氧根离子浓度不变;氢氧根离子浓度⑥>⑤.
解答 解:(1))③醋酸、⑥NaOH溶液混合,溶液呈中性,依据醋酸是弱酸分析,同体积溶液混合溶液呈碱性,若溶液呈中性需要酸稍过量③>⑥;
溶液中存在电荷守恒,C(Na+)+C(H+)=C(OH-)+C(CH3COO-)中性溶液中C(OH-)=C(H+);所以溶液中离子浓度大小关系为:C(Na+)=C(CH3COO-)>C(OH-)=C(H+);
故答案为:>;C(Na+)=C(CH3COO-)>C(OH-)=C(H+);
(2)将等体积的①盐酸、⑤氨水混合,溶液浓度相同,恰好反应生成氯化铵溶液,铵根离子水解显酸性;溶液PH<7;原因是氯化铵溶液中铵根离子水解生成一水合氨和氢离子,溶液厂酸性;离子方程式为:NH4++H2O?NH3•H2O+H+;
故答案为:<;NH4++H2O?NH3•H2O+H+;
(3)向相同体积的:①盐酸、②硫酸、③醋酸溶液中分别加入相同的且足量的锌粒,浓度均为1×10-3mol/L溶质物质的量相同,盐酸和硫酸是强酸,醋酸是弱酸,溶液中氢离子浓度②>①>③;产生氢气②>①═③;故答案为:②①③;②>①=③;
(4)向相同体积的①盐酸、③醋酸溶液中分别加入相同浓度、相同体积的CH3COONa溶液,①中和盐酸恰好完全反应生成醋酸和氯化钠,③中醋酸根离子对醋酸电离起到抑制作用,氢离子浓度减小;混合液的pH 大小关系①<③;故答案为:<;
(5)若将等体积、等浓度的⑤氨水、⑥NaOH溶液,氨水中的溶质是弱碱存在电离平衡,溶液PH⑥>⑤;溶液加热至相同温度后,⑤溶液电离促进,氢氧根离子浓度增大,但不能完全电离;⑥溶液中离子积增大,氢氧根离子浓度不变;氢氧根离子浓度⑥>⑤;故答案为:<.
点评 本题考查了溶液中离子浓度大小的比较方法,溶液中电荷守恒的应用,弱电解质电离平衡的影响因素,溶液PH的判断,酸碱反应后的溶液酸碱性的判断,题目难度较大.

| A. | 吃馒头时多咀嚼后有甜味 | |
| B. | 淀粉溶液和稀H2SO4共热一段时间后,滴加碘水不显蓝色 | |
| C. | 把生鸡蛋煮成熟鸡蛋 | |
| D. | 油脂与NaOH溶液共煮后可以制得肥皂 |
| A. | Fe(OH)3 | B. | FeCl3 | C. | CuS | D. | FeCl2 |
| A. | 热化学方程式中的化学计量数表示物质的量,可以是分数 | |
| B. | △H>0 kJ•mol-1表示放热反应,△H<0 kJ•mol-1表示吸热反应 | |
| C. | 1 mol H2SO4与1 molBa(OH)2反应生成H2O时放出的热叫做中和热 | |
| D. | 1 mol H2与0.5 molO2反应放出的热就是H2的燃烧热 |
| A. | 实验室常用如图所示的装置制取少量的乙酸乙酯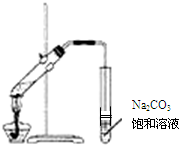 | |
| B. | 制备乙酸乙酯时,向乙醇中缓慢加入浓硫酸和冰醋酸 | |
| C. | 用玻璃棒搅拌漏斗中的液体以加快过滤的速度 | |
| D. | 用苯萃取溴水中的溴,分液时有机层从分液漏斗的上端倒出 |

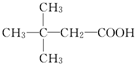
| A. | 它有酸性,能与纯碱溶液反应 | |
| B. | 它在一定条件下能发生水解,且产物只有一种 | |
| C. | 1 mol该有机物最多能与7 mol NaOH反应 | |
| D. | 1 mol该有机物最多能与4 mol Br2反应 |
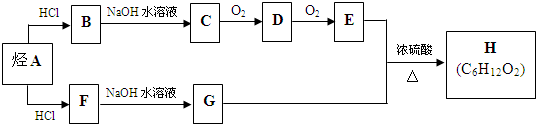
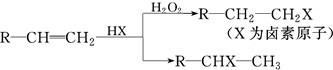
 .(用结构简式表示)
.(用结构简式表示) 转化率
转化率