题目内容
9.在标准状况下,将VLA气体(摩尔质量为Mg/mol)溶于0.1L水中,所得溶液密度为dg/ml,则此溶液的物质的量浓度为( )(单位为mol/L)| A. | $\frac{MV}{22.4(V+0.1)d}$ | B. | $\frac{1000VdM}{MV+2240}$ | C. | $\frac{1000Vd}{MV+2240}$ | D. | $\frac{Vd}{MV+2240}$ |
分析 根据n=$\frac{V}{{V}_{m}}$来计算气体的物质的量,根据m=nM计算气体的质量,根据m=ρV计算水的质量,溶剂和溶质的质量和为溶液的质量,利用V=$\frac{m}{ρ}$来计算溶液的体积,最后利用c=$\frac{n}{V}$来计算该溶液的物质的量浓度.
解答 解:气体的物质的量=$\frac{VL}{22.4L/mol}$=$\frac{V}{22.4}$mol,故气体的质量=$\frac{V}{22.4}$mol×Mg/mol=$\frac{VM}{22.4}$g,0.1L水的质量为100mL×1g/mL=100g,溶液的质量为(100+$\frac{VW}{22.4}$)g,溶液的体积为$\frac{(100+\frac{VM}{22.4})g}{1000dg/L}$=$\frac{2240+VM}{22400d}$L,所以溶液的物质的量浓度=$\frac{V}{22.4}$mol÷$\frac{2240+VM}{22400d}$L=$\frac{1000dV}{2240+VM}$mol/L.
故选C.
点评 本题考查物质的量浓度的有关计算,属于字母型计算,增大题目难度,计算溶液的体积是解题关键,注意对公式的理解与灵活运用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.碳具有还原性,能与氧化铜发生反应:2CuO+C $\frac{\underline{\;高温\;}}{\;}$ 2Cu+CO2↑,该反应的基本类型为( )
| A. | 置换反应 | B. | 化合反应 | C. | 分解反应 | D. | 复分解反应 |
20.下列关于原电池说法正确的是( )
| A. | 原电池是一种直接把化学能转化为电能的装置,在此转化过程中无能量损耗 | |
| B. | 在Zn-Cu-H2SO4构成的原电池中,H+不断移向负极 | |
| C. | 钢铁在潮湿的环境中易被腐蚀与原电池有关 | |
| D. | 纯铁比生铁(含有少量杂质)与稀HCl反应快 |
17.下列物质中,不能用直接化合制取的是( )
| A. | Fe(OH)3 | B. | FeCl3 | C. | CuS | D. | FeCl2 |
4.下列物质既能够与强酸又能够与强碱反应,且反应后都能产生气体的是( )
| A. | 硫化铵 | B. | 亚硫酸氢钾 | C. | 碳酸氢钠 | D. | 硫酸氢铵 |
1.下列说法中,正确的是( )
| A. | 热化学方程式中的化学计量数表示物质的量,可以是分数 | |
| B. | △H>0 kJ•mol-1表示放热反应,△H<0 kJ•mol-1表示吸热反应 | |
| C. | 1 mol H2SO4与1 molBa(OH)2反应生成H2O时放出的热叫做中和热 | |
| D. | 1 mol H2与0.5 molO2反应放出的热就是H2的燃烧热 |
18.某有机化合物的结构简式如图所示,下列叙述不正确的是( )


| A. | 它有酸性,能与纯碱溶液反应 | |
| B. | 它在一定条件下能发生水解,且产物只有一种 | |
| C. | 1 mol该有机物最多能与7 mol NaOH反应 | |
| D. | 1 mol该有机物最多能与4 mol Br2反应 |
19.下列说法正确的是( )
| A. | 共价化合物中不可能含有离子键 | |
| B. | 只有金属元素和非金属元素才能形成离子键 | |
| C. | 水分子很稳定,因为水分子间存在氢键 | |
| D. | 所有的分子晶体内都存在两种以上作用力 |
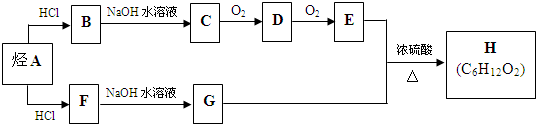
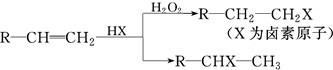
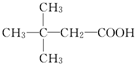 .(用结构简式表示)
.(用结构简式表示)