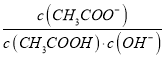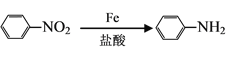题目内容
【题目】捕集、利用CO2是人类可持续发展的重要战略之一。
(1)用太阳能工艺捕获CO2可得炭黑,其流程如图所示:

①捕获1mo1CO2转移电子的物质的量是_________。
②过程2反应的化学方程式是________。
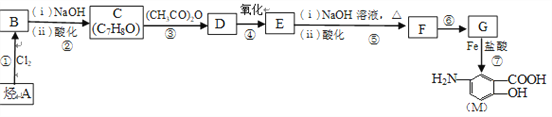
(2)将CO2催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g),按投料比n(CO2):n(H2)=1:3将CO2与H2充入密闭容器,在0.1MPa时,测得平衡时四种气态物质,其温度(T)与物质的量(n)的关系如图所示。
C2H4(g)+4H2O(g),按投料比n(CO2):n(H2)=1:3将CO2与H2充入密闭容器,在0.1MPa时,测得平衡时四种气态物质,其温度(T)与物质的量(n)的关系如图所示。

①正反应的焓变△H_________0。
②提高CO2的转化率,可采用的方法是______。
a.增大n(CO2)与n(H2)的投料比
b.改变催化剂
c.缩小容器体积
③图中表示水的曲线是_____。
(3)电解CO2可制得多种燃料:下图是在酸性电解质溶液中,以惰性材料做电极将CO2转化为丙烯的原理模型。

①太阳能电池的正极是________。
②生成丙烯的电极反应式是___________。
【答案】 4mol 6FeO + CO2 = 2Fe3O4 + C < c b b 3CO2 + 18H+ + 18e- = CH2=CH-CH3 + 6H2O
【解析】(1)①从图中流程来看CO2~C~4mole-,故捕获1molCO2转移电子的物质的量是4mol;②过程2是FeO和CO2反应生成Fe3O4和C,故化学方程式为6FeO+CO2=2Fe3O4+C;(2)①由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,则正反应放热,△H<0;②为提高CO2的平衡转化率,除改变温度外,还可采取的措施是增大压强或者减少n(CO2)与n(H2)的投料比,都能使平衡向正反应方向进行,催化剂不能改变平衡状态,答案选c;③随着温度升高,氢气的物质的量逐渐增多,因氢气为反应物,则另一条逐渐增多的曲线为CO2,由计量数关系可知b为水,c为C2H4的变化曲线;(3)①右侧电极产生氧气,说明是阳极,氢氧根放电,因此太阳能电池的正极是b;②电解时,二氧化碳在阴极上得到电子生成丙烯,电极反应式为3CO2+18H++18e-=CH3-CH=CH2+6H2O。

 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案