题目内容
【题目】常温下,Ka (HCOOH)=1.77×10-4,Ka (CH3COOH)=1.75×10-5,Kb (NH3·H2O) =1.76×10-5,下列说法正确的是( )
A. 将CH3COONa溶液从20℃升温至30℃,溶液中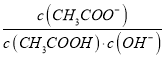 增大
增大
B. 用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积相等
C. 0.2 mol/L HCOOH 与 0.1 mol/L NaOH 等体积混合后:c(HCOO-) + c(OH-) = c(HCOOH) + c(H+)
D. 0.2 mol/L CH3COONa 与 0.1 mol/L盐酸等体积混合后 (pH<7):c(CH3COO-) > c(Cl- ) >c(CH3COOH) >c(H+)
【答案】D
【解析】CH3COONa的水解过程为吸热,所以升高温度,平衡右移,水解平衡常数c(OH-) ×c(CH3COOH) /c(CH3COO-)增大,溶液中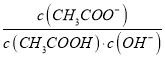 减小,A错误;pH相同的HCOOH和
减小,A错误;pH相同的HCOOH和![]() ,浓度:
,浓度:![]() ,用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和
,用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和![]() 溶液至终点时,酸的浓度越大,消耗的碱体积越大,pH、体积相同的HCOOH和
溶液至终点时,酸的浓度越大,消耗的碱体积越大,pH、体积相同的HCOOH和![]() ,物质的量前者小于后者,所以后者消耗的NaOH体积多,B错误;两溶液等体积混合后得到甲酸和甲酸钠溶液,由电荷守恒c(H+)+c(Na+)=c(OH-)+c(HCOO-)和物料守恒2c(Na+)=c(HCOOH)+c(HCOO-)可得c(HCOO-) + 2c(OH-) = c(HCOOH) + 2c(H+),C项错误;二者混合后溶液中的溶质为等物质的量浓度的
,物质的量前者小于后者,所以后者消耗的NaOH体积多,B错误;两溶液等体积混合后得到甲酸和甲酸钠溶液,由电荷守恒c(H+)+c(Na+)=c(OH-)+c(HCOO-)和物料守恒2c(Na+)=c(HCOOH)+c(HCOO-)可得c(HCOO-) + 2c(OH-) = c(HCOOH) + 2c(H+),C项错误;二者混合后溶液中的溶质为等物质的量浓度的![]() 、
、![]() 和NaCl,混合溶液的
和NaCl,混合溶液的![]() ,说明醋酸电离程度大于醋酸钠水解程度,乙酸是弱酸,其电离程度较小,所以粒子浓度大小顺序是c(CH3COO-) > c(Cl- ) >c(CH3COOH) >c(H+);D正确;正确选项D。
,说明醋酸电离程度大于醋酸钠水解程度,乙酸是弱酸,其电离程度较小,所以粒子浓度大小顺序是c(CH3COO-) > c(Cl- ) >c(CH3COOH) >c(H+);D正确;正确选项D。

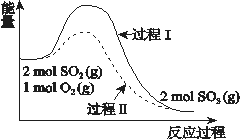
【题目】碳、氮及其化合物在工农业生产生活中有着重要作用。请回答下列问题:
(1)汽车尾气中的处理NO的方法也可用H2将NO还原为N2。
已知: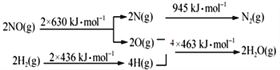
H2还原NO生成氮气和水蒸气的热化学方程是_______________________________。
(2)高炉炼铁产生的高炉气中含有CO、H2、CO2等气体,利用CO和H2在催化剂作用下合成甲醇,是减少污染、节约能源的一种新举措,反应原理为CO(g)+2H2(g)![]() CH3OH(g) ΔH。在体积不同的两个恒容密闭容器中分别充入1molCO和2mol H2,测得平衡混合物中CH3OH 的体积分数在不同压强下随温度的变化如图。
CH3OH(g) ΔH。在体积不同的两个恒容密闭容器中分别充入1molCO和2mol H2,测得平衡混合物中CH3OH 的体积分数在不同压强下随温度的变化如图。
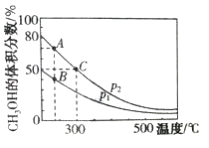
①上述合成甲醇的反应是__________________(填“吸热”或“放热”)反应,图像中的压强p1、p2的大小关系是_______________,判断的理由是________________________。
②从上图A、B、C三点中选填下表物理量对应最大的点(用“A”、“B”或“C”填写)。
反应速率V | 平衡常数K | 平衡转化率a |
____________ | _____________ | _____________ |
③在300℃时,向C点平衡体系中再充入0.25molCO、0.5molH2和0.25molCH3OH。该平衡_________(填“向正反应方向”、“向逆反应方向”或“不”)移动。
(3)有利于提高CO平衡转化率的措施有_________________。
A.使用催化剂 B.投料比不变,增加CO的浓度
C.降低反应温度 D.通入He气体使体系的压强增大
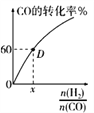
(4)一定温度下,CO的转化率与起始投料比![]() 的变化关系如图所示,测得D点氢气的转化率为40%,则x=__________________。
的变化关系如图所示,测得D点氢气的转化率为40%,则x=__________________。