题目内容
17.用惰性电极电解Fe2(SO4)3和CuSO4的混合溶液,下列说法正确的是( )| A. | 阴极反应式为:Cu2++2e-═Cu,当有Cu2+存在时,Fe3+不放电 | |
| B. | 阴极上首先析出铁,然后析出铜 | |
| C. | 阴极先是Fe3+放电,后Cu2+放电 | |
| D. | 阴极上不可能析出铜 |
分析 由反应Fe2(SO4)3+Cu=2FeSO4+CuSO4可知,氧化性:Fe3+>Cu2+,则Fe3+得电子能力比Cu2+强,所以,在阴极首先得电子的是Fe3+(Fe3++e-=Fe2+),即Fe2(SO4)3溶液先被电解,CuSO4溶液后被电解,以此解答该题.
解答 解:A.由反应Fe2(SO4)3+Cu=2FeSO4+CuSO4可知,氧化性:Fe3+>Cu2+,则Fe3+得电子能力比Cu2+强,所以,在阴极首先得电子的是Fe3+,当Fe3+存在时,Cu2+不放电,故A错误;
B.当Fe3+完全反应即Fe3++e-=Fe2+,后Cu2+放电,则首先析出铜,故B错误;
C.因氧化性:Fe3+>Cu2+,阴极先是Fe3+放电,后Cu2+放电,故C正确;
D.由B分析可知,当Fe3+完全反应后Cu2+放电,可析出铜,故D错误.
故选C.
点评 本题考查电解原理,题目难度不大,本题注意判断氧化性:Fe3+>Cu2+,是解答该题的关键,易错点为B,注意当Fe3+完全反应后Cu2+放电,可析出铜.

练习册系列答案
相关题目
8.取少量MgO、Al2O3、SiO2、Fe2O3的混合粉末,加入过量盐酸,充分反应后过滤,得到沉淀X和滤液Y.下列叙述正确的是( )
| A. | 上述四种氧化物中,只有SiO2是酸性氧化物,它不溶于任何酸 | |
| B. | 向沉淀X中逐滴加入硝酸,沉淀慢慢溶解 | |
| C. | 溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+、H+ | |
| D. | 溶液Y中加入过量氨水,所得沉淀为Fe(OH)3和Mg(OH)2 |
5.下列反应中氧化剂和还原剂的物质的量之比为1:2的是( )
| A. | 铜和浓硝酸反应 | B. | 工业合成氨的反应 | ||
| C. | 工业制粗硅的反应 | D. | 铜和浓硫酸反应 |
2.2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系.下列叙述错误的是( )
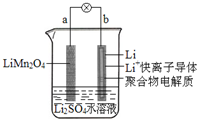

| A. | 理论上外电路中每转移1mol电子,负极消耗的质量为7g | |
| B. | 可以将Li+快离子导体更换成阳离子交换膜,去掉聚合物电解质直接使用Li2SO4水溶液 | |
| C. | 电池放电反应为 Li1-xMn2O4+xLi═LiMn2O4 | |
| D. | 放电时,溶液中的Li+从b向a迁移 |
9.下列叙述正确的是( )
| A. | 元素处于最高价态,一定具有最强的氧化性 | |
| B. | 阳离子只有氧化性,阴离子只有还原性 | |
| C. | 还原剂失电子越多,还原性越强 | |
| D. | 在化学反应中,某元素由化合态变为游离态,此元素可能被氧化,也可能被还原 |
6.化学与人类生产、生活,社会可持续发展密切相关.下列说法正确的是( )
| A. | 蔬菜表面洒少许福尔马林,可保鲜和消毒 | |
| B. | 绿色食品就是不使用化肥农药,不含任何化学物质的食品 | |
| C. | 光催化水制氢比电解水制氢更节能环保 | |
| D. | 光化学烟雾不会引起呼吸道疾病 |

 .
. .
.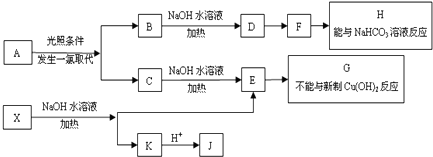
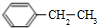 .写出三种属于芳香烃类的A的同分异构体
.写出三种属于芳香烃类的A的同分异构体 、
、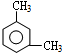 、
、 .(不包括A,写结构简式)
.(不包括A,写结构简式) +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O;反应类型是氧化反应.C→E反应的化学方程是
+2H2O;反应类型是氧化反应.C→E反应的化学方程是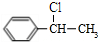 +NaOH $→_{△}^{水}$
+NaOH $→_{△}^{水}$ +NaCl;
+NaCl; ;反应类型是氧化反应.
;反应类型是氧化反应.