题目内容
【题目】设X、Y、Z代表3种短周期元素,已知:
①Ym-和Zn-两种离子是有相同的电子层结构
②X与Y可以形成原子个数比为1:1的化合物甲和2:1的化合物乙,甲、乙都是共价化合物
③X与Z形成原子个数比为1:1的化合物丙,其分子与乙的分子所含质子数相同。据此,填写下面空白:
(1)Ym-的离子结构示意图为_________,Z元素是___________
(2)化合物甲的电子式是____________
(3)Z单质与化合物乙反应的化学方程式是________________
(4)化合物丙与氢氧化钠溶液反应的离子方程式是_______________
【答案】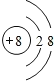 F
F ![]() 2F2+2H2O===4HF+O2 HF+OH-===F-+H2O
2F2+2H2O===4HF+O2 HF+OH-===F-+H2O
【解析】
Ym-和Zn-两种离子是有相同的电子层结构说明Y、Z元素同一周期;X与Y、X与Z均能形成化合物,则X应显正价;X与Y可以形成原子个数比为1:1的化合物甲和2:1的化合物乙,甲、乙都是共价化合物,满足该条件的有:
①N和O形成的NO和N2O,即X为N,Y为O;N2O所含质子数为22,则Z的质子数为22-7=15,为P元素,与“Y、Z元素同一周期”矛盾,故该假设不成立;
②H和O形成的H2O2和H2O,即X为H,Y为O;H2O质子数为10,则Z的质子数为10-1=9,为F元素,符合条件;
综上所述X为H,Y为O,Z为F。
(1)Ym-即O2-离子结构示意图为: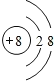 ;Z元素为F;
;Z元素为F;
(2)化合物甲为过氧化氢,其电子式为:![]() ;
;
(3)F2与水的反应方程式为:2F2+2H2O===4HF+O2;
(4)HF与氢氧化钠反应生成氟化钠和水,氢氟酸为弱酸,所以离子方程式为:HF+OH-===F-+H2O。

【题目】下列实验操作规范且能达到实验目的的是
选项 | 实验目的 | 操作 |
A | 取20.00 mL盐酸 | 在25 mL酸式滴定管中装入盐酸。调整初始读数为5.00 mL后,将剩余盐酸全部放入锥形瓶中 |
B | 测量饱和Na2CO3溶液的pH值 | 用蒸馏水湿润pH试纸,放入Na2CO3溶液中,观察pH试纸颜色,并与比色卡对比,读出pH值 |
C | 制取纯净的FeCl 3固体 | 加热蒸干FeCl3溶液 |
D | 验证Ksp[Cu(OH)2]< Ksp[Mg(OH)2] | 将0.1 mol·L-1 MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1 mol/L CuSO4溶液 |
A. A B. B C. C D. D