题目内容
【题目】下列实验操作规范且能达到实验目的的是
选项 | 实验目的 | 操作 |
A | 取20.00 mL盐酸 | 在25 mL酸式滴定管中装入盐酸。调整初始读数为5.00 mL后,将剩余盐酸全部放入锥形瓶中 |
B | 测量饱和Na2CO3溶液的pH值 | 用蒸馏水湿润pH试纸,放入Na2CO3溶液中,观察pH试纸颜色,并与比色卡对比,读出pH值 |
C | 制取纯净的FeCl 3固体 | 加热蒸干FeCl3溶液 |
D | 验证Ksp[Cu(OH)2]< Ksp[Mg(OH)2] | 将0.1 mol·L-1 MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1 mol/L CuSO4溶液 |
A. A B. B C. C D. D
【答案】D
【解析】
A. 滴定管的下端无刻度;
B. pH试纸不能润湿,且需用玻璃棒蘸取待测液,而不是直接放入待测液中;
C. FeCl3溶液会发生水解;
A. 滴定管的下端无刻度,则剩余盐酸放入锥形瓶其体积大于20.00 mL,故A项错误;
B. 测量饱和Na2CO3溶液的pH值时,其正确的操作为:用玻璃棒蘸取待测液放在干燥的pH试纸上,用标准比色卡进行对比,读出其pH值,故B项错误;
C. 由于FeCl3溶液存在水解平衡,其水解方程式为:FeCl3 + 3H2O![]() Fe(OH)3 + 3HCl,加热蒸干FeCl3溶液时,氯化氢易挥发,且升温促进水解向正反应方向移动,最后不会得到FeCl3,则不能达到实验目的,故C项错误;
Fe(OH)3 + 3HCl,加热蒸干FeCl3溶液时,氯化氢易挥发,且升温促进水解向正反应方向移动,最后不会得到FeCl3,则不能达到实验目的,故C项错误;
D. 将0.1 mol·L-1 MgSO4溶液滴入NaOH溶液至不再有沉淀产生,说明镁离子均以氢氧化镁沉淀的形式生成,再滴加0.1 mol/L CuSO4溶液时,产生蓝色沉淀,则可以说明氢氧化铜的溶解度小于氢氧化镁的溶解度,因沉淀类型相同,则进一步验证了Ksp[Cu(OH)2]< Ksp[Mg(OH)2],故D项正确;
答案选D。

 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案【题目】下列实验现象不能充分说明相应的化学反应是放热反应的是
选项 | A | B | C | D |
反应装置或图像 |
|
|
|
|
实验现象或图像信息 | 反应开始后,针筒活塞向右移动 | 反应开始后,甲侧液面低于乙侧液面 | 温度计的水银柱上升 | 反应开始后,气球慢慢胀大 |
A. A B. B C. C D. D
【题目】CO、CO2是含碳元素的常见气体,也是参与碳循环的重要物质。
(1)利用煤化工中产生的CO和H2可制取甲醇,反应为CO(g)+2H2(g)![]() CH3OH(g)。实验室中,在1L恒容的密闭容器中进行模拟合成实验。将1molCO和2molH2通入容器中,分别恒温在300℃和500℃反应,每隔一段时间测得容器内CH3OH的物质的量(单位:mol)如下表所示:
CH3OH(g)。实验室中,在1L恒容的密闭容器中进行模拟合成实验。将1molCO和2molH2通入容器中,分别恒温在300℃和500℃反应,每隔一段时间测得容器内CH3OH的物质的量(单位:mol)如下表所示:
10min | 20min | 30min | 40min | 50min | 60min | |
300℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
500℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
①300℃和500℃对应的平衡常数大小关系为K300℃_________K500℃(填“>”、“=”或“<”)。
②在一定条件下,下列描述中能说明上述反应已达平衡的是_______(填标号)。
A.容器内气体的平均摩尔质量保持不变
B.2v(H2)正=v(CH3OH)逆
C.容器中气体的压强保持不变
D.单位时间内生成nmolCO的同时生成2nmolH2
③300℃时,前10min内,该反应的平均反应速率为v(H2)=_________mol/(L·min)。
④下列措施能够增大此反应中CO的转化率的是_________(填标号)。
A.充入CO气体B.升高温度
C.使用优质催化剂D.往容器中再充入1molCO和2molH2
⑤500℃时,保持反应体系的温度不变,60min时再向容器中充入CH3OH气体和H2各0.4mol,反应将向____________________(填“正反应方向”、“逆反应方向”或“不”)进行。再次达到平衡时的平衡常数为____________L2/mol2。
(2)二氧化碳催化加氢也可合成甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H。在密闭容器中投入1molCO2和2.75molH2,在不同条件下发生反应,实验测得平衡时甲醇的物质的量随温度、压强的变化如下图所示.
CH3OH(g)+H2O(g)△H。在密闭容器中投入1molCO2和2.75molH2,在不同条件下发生反应,实验测得平衡时甲醇的物质的量随温度、压强的变化如下图所示.
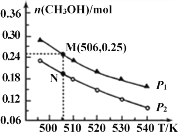
①二氧化碳合成甲醇正反应的△H______0(填“>”、“<”或“=”,下同)。
②M、N两点时化学反应速率:v(N)______v(M)。
(3)一定条件下,向容积不变的某密闭容器中加入amolCO2和bmolH2发生反应:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),欲使整个反应过程中CO2的体积分数为恒定值,则a与b的大小关系式是_________。
CH3OH(g)+H2O(g),欲使整个反应过程中CO2的体积分数为恒定值,则a与b的大小关系式是_________。
(4)以TiO2/Cu2Al2O4为催化剂,可以将COspan>2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图所示。当乙酸的生成速率主要取决于温度时,其影响范围是_______________________。

【题目】一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示:
N2(g)+2CO2(g)。各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示:

容器 | 温度/℃ | 起始物质的量/mol | |
NO (g) | CO (g) | ||
甲 | T1 | 0.20 | 0.20 |
乙 | T1 | 0.30 | 0.30 |
丙 | T2 | 0.20 | 0.20 |
下列说法正确的是
A. 该反应的正反应为吸热反应
B. 达到平衡时,乙中CO2的体积分数比甲中的小
C. T1℃时,若起始时向甲中充入0.40 mol NO、0.40mol CO、0.40mol N2和0.40mol CO2,则反应达到新平衡前v(正)<v(逆)
D. T2℃时,若起始时向丙中充入0.06molN2和0.12 molCO2,则达平衡时N2的转化率大于40%