题目内容
【题目】铬矿是冶金、国防、化工等领域不可缺少的矿产资源,其中的铬铁矿是唯一可开采的铬矿石。工业上常用铬铁矿(主要含Fe2O3、FeO和Cr2O3,还含有MgO、Al2O3、SiO2等杂质)为原料制备重铬酸钾和三氧化二铁,其流程如图所示。

已知常见离子开始生成沉淀和沉淀完全的pH如下表所示。

请回答下列问题:
(1)铬铁矿与熔融 NaOH 和 NaCIO3的反应是在坩埚中进行的,可用作此坩埚材料的是___________.
A.镍 B.刚玉(Al2O3) C. 陶瓷 D.石英
(2)写出铬铁矿中的Cr2O3与熔融 NaOH和NaCIO3反应的化学方程式:___。由于在该过程中铁元素会大量转变为NaFeO2,所以加水的作用为__________________(用离子方程式表示)。
(3)“滤渣 2”的主要成分为_________(填化学式)。
(4)利用化学平衡移动原理解释调节pH2约至4.5的原因是;再向其中加入KC1固体,蒸发浓缩至液体表面有晶膜产生,冷却结晶,过滤得到粗重铬酸钾晶体。为获得高纯度重铬酸钾晶体,可采取___________(填操作名称)。
(5)调节pH3的范围为__________
(6)已知铬铁矿中铁、铬元素的质量比为14:13.上述流程中铁元素转化为Fe2O3的利用率为60%,提取铬元素的转化率为90%,如果得到Fe2O3的质量为32t,则可以制备K2Cr2O7的质量为______t(结果保留1位小数)。
【答案】A Cr2O3+4NaOH+NaClO3![]() Na2CrO4+NaCl+2H2O FeO2-+2H2O=OH-+Fe(OH)3↓ H2SiO3、Al(OH)3 因为存在平衡:2H++2CrO42-
Na2CrO4+NaCl+2H2O FeO2-+2H2O=OH-+Fe(OH)3↓ H2SiO3、Al(OH)3 因为存在平衡:2H++2CrO42-![]() Cr2O72-+H2O,增大c(H+)使平衡正向移动,有利于产生Cr2O72- 3.2≦pH3<8.1 88.2
Cr2O72-+H2O,增大c(H+)使平衡正向移动,有利于产生Cr2O72- 3.2≦pH3<8.1 88.2
【解析】
结合题中的信息和工艺流程图,铬铁矿的Cr2O3、Fe2O3、FeO、Al2O3、SiO2与熔融 NaOH 和 NaCIO3反应生成Na2CrO4、NaFeO2、NaAlO2、Na2SiO3,从滤渣4灼烧得三氧化二铁可知,加水,滤液1的溶质含有Na2CrO4、NaAlO2、Na2SiO3,滤渣1的成分为Fe(OH)3、MgO;滤液3里面主要含有Fe3+、Mg2+,通过调节pH3使Fe3+完全沉淀,而不Mg2+沉淀;滤液1的溶质含有Na2CrO4、NaAlO2、Na2SiO3,通过调节pH1,使NaAlO2、Na2SiO3,转化为H2SiO3、Al(OH)3;滤液2通过调节pH2使CrO42-转化为Cr2O72-;根据铬铁矿中铁、铬元素的质量比为14:13,即物质的量之比为1:1,再根据利用率可知,得到的Fe、Cr元素的物质的量之比为2:3,然后根据Fe2O3的质量计算出K2Cr2O7的质量。
(1)A.镍不与氢氧化钠反应,镍可以作此坩埚材料,A正确;
B.Al2O3能与氢氧化钠反应,故刚玉(Al2O3)不可以作此坩埚材料,B错误;
C.陶瓷的成分中含有二氧化硅,二氧化硅能与氢氧化钠反应,故陶瓷不可以作此坩埚材料,C错误;
D.石英的成分是二氧化硅,二氧化硅能与氢氧化钠反应,故陶瓷不可以作此坩埚材料,D错误;
答案选A;
(2)Cr2O3与熔融 NaOH和NaCIO3反应,被Cr2O3氧化为Na2CrO4,NaCIO3被还原为NaCI,其反应方程式为Cr2O3+4NaOH+NaClO3 ![]() Na2CrO4+NaCl+2H2O;由流程图可以看出,Fe元素在过滤后进入滤渣中,说明NaFeO2能与水反应生成Fe(OH)3,反应方程式为FeO2-+2H2O=OH-+Fe(OH)3↓;
Na2CrO4+NaCl+2H2O;由流程图可以看出,Fe元素在过滤后进入滤渣中,说明NaFeO2能与水反应生成Fe(OH)3,反应方程式为FeO2-+2H2O=OH-+Fe(OH)3↓;
(3)在第一步中能溶于氢氧化钠的除了 Cr2O3,还有Al2O3和SiO2,分别形成AlO2-和SiO32-,所以调节pH1的目的应该是为了出去Al元素和Si元素,故“滤渣2”的主要成分为H2SiO3、Al(OH)3;
(4)本过程的目的是为了获得重铬酸钾,所以调节pH2的目的是将CrO42-转化为Cr2O72-,存在平衡2H++2CrO42-![]() Cr2O72-+H2O,增大c(H+)使平衡正向移动,有利于Cr2O72-的生成。从粗重铬酸钾晶体中获得高纯度重铬酸钾晶体的方法为重结晶;
Cr2O72-+H2O,增大c(H+)使平衡正向移动,有利于Cr2O72-的生成。从粗重铬酸钾晶体中获得高纯度重铬酸钾晶体的方法为重结晶;
(5)“滤液3”中主要存在的金属离子为Fe3+、Mg2+,为了得到Fe(OH)3沉淀而不使Mg2+沉淀,应调节pH3的范围是3.2≦pH3<8.1;

【题目】某研究小组同学欲探究某袋敞口放置一段时间的名为“硫酸亚铁家庭园艺精品肥料”的化肥的主要成分及相关性质。首先对该化肥的成分进行了如下假设:
a.只含有FeSO4
b.含有FeSO4和Fe2(SO4)3
c.只含有Fe2(SO4)3
将化肥固体粉末溶于水中得到溶液(记为X),进行如下实验:
实验序号 | 操作 | 现象 |
ⅰ | 取2 mL溶液X,加入1 mL 1 mol·L-1 NaOH溶液 | 产生红褐色沉淀 |
ⅱ | 取2 mL溶液X,加入1滴KSCN | 溶液显红色 |
(1)请用文字表述做出假设b的依据是__________________________。
(2)对实验ⅰ的预期现象是产生白色沉淀、变为灰绿色、最后出现红褐色沉淀,预期产生该现象的依据是(用化学方程式或离子方程式表达)_____、_____。
(3)由实验ⅱ得出的结论是____________。结合实验ⅰ、ⅱ,推测实验ⅰ实际现象与预期现象不符的原因可能是_____________________________。为进一步验证假设,小组同学进行了以下实验:
实验序号 | 操作 | 现象 |
ⅲ | 取2 mL溶液X,加入1滴KSCN,再加入1 mL水 | 溶液显红色 |
ⅳ | 取2 mL溶液X,加入1滴KSCN,再加入1 mL氯水 | 溶液显红色,颜色比ⅲ深 |
(4)实验ⅳ中氯水参加反应的离子方程式是_______________________。
(5)通过以上实验,可得到的结论是_____________________________,请完整表达该结论是如何得出的_______________________________。
【题目】CS2是一种常见溶剂,还可用于生产人造粘胶纤维等。回答下列问题:
(1)CS2与酸性KMnO4溶液反应,产物为CO2和硫酸盐,该反应中还原剂与氧化剂的物质的量之比为__________(MnO4-被还原为Mn2+)。
(2)甲烷硫磺法制取CS:的反应为CH4(g)+2S2(g)![]() CS2(g)+2H2S(g) △H
CS2(g)+2H2S(g) △H
①在恒温恒容密闭容器中进行该反应时,能说明该反应已达到平衡状态的是_________(填字母)。
A.v正(S2)=2v逆(CS2)
B.容器内气体的密度不再随时间变化
C.容器内气体的总压强不再随时间变化
D.单位时间内断裂C-H键数目与断裂H-S键数目相等
②已知下列键能数据:
共价键 | C-H | S=S | C=S | H-S |
键能/ | 411 | 425 | 573 | 363 |
该反应的△H=_________kJ·mol-1。
(3)在一密闭容器中,起始时向该容器中充入H2S和CH4且n(H2S):n(CH4)=2:1,发生反应:CH4(g)+2H2S(g)![]() CS2(g)+4H2(g)。0.1MPa时,温度变化对平衡时产物的物质的量分数的影响如图所示:
CS2(g)+4H2(g)。0.1MPa时,温度变化对平衡时产物的物质的量分数的影响如图所示:
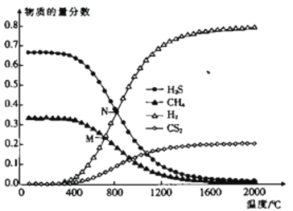
①该反应△H_________(填“>”或“<”)0。
②M点对应温度下,H2S的平衡转化率为_________,为提高H2S的平衡转化率,除改变温度外,还可采取的措施是___________________________(列举一条)。
③N点,平衡分压p(CS2)=_________MPa,对应温度下,该反应的Kp=_________(MPa)2。(Kp为以分压表示的平衡常数)