ĢāÄæÄŚČŻ
”¾ĢāÄæ”æCS2ŹĒŅ»ÖÖ³£¼ūČܼĮ£¬»¹æÉÓĆÓŚÉś²śČĖŌģÕ³½ŗĻĖĪ¬µČ”£»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)CS2ÓėĖįŠŌKMnO4ČÜŅŗ·“Ó¦£¬²śĪļĪŖCO2ŗĶĮņĖįŃĪ£¬øĆ·“Ó¦ÖŠ»¹Ō¼ĮÓėŃõ»Æ¼ĮµÄĪļÖŹµÄĮæÖ®±ČĪŖ__________(MnO4£±»»¹ŌĪŖMn2£«)”£
(2)¼×ĶéĮņ»Ē·ØÖĘČ”CS£ŗµÄ·“Ó¦ĪŖCH4(g)£«2S2(g)![]() CS2(g)£«2H2S(g) ”÷H
CS2(g)£«2H2S(g) ”÷H
¢ŁŌŚŗćĪĀŗćČŻĆܱÕČŻĘ÷ÖŠ½ųŠŠøĆ·“Ó¦Ź±£¬ÄÜĖµĆ÷øĆ·“Ó¦ŅŃ“ļµ½Ę½ŗāדĢ¬µÄŹĒ_________(Ģī×ÖÄø)”£
A.vÕż(S2)£½2vÄę(CS2)
B.ČŻĘ÷ÄŚĘųĢåµÄĆÜ¶Č²»ŌŁĖꏱ¼ä±ä»Æ
C.ČŻĘ÷ÄŚĘųĢåµÄ×ÜŃ¹Ēæ²»ŌŁĖꏱ¼ä±ä»Æ
D.µ„Ī»Ź±¼äÄŚ¶ĻĮŃC£H¼üŹżÄæÓė¶ĻĮŃH£S¼üŹżÄæĻąµČ
¢ŚŅŃÖŖĻĀĮŠ¼üÄÜŹż¾Ż£ŗ
¹²¼Ū¼ü | C-H | S=S | C=S | H-S |
¼üÄÜ/ | 411 | 425 | 573 | 363 |
øĆ·“Ó¦µÄ”÷H£½_________kJ”¤mol£1”£
(3)ŌŚŅ»ĆܱÕČŻĘ÷ÖŠ£¬ĘšŹ¼Ź±ĻņøĆČŻĘ÷ÖŠ³äČėH2SŗĶCH4ĒŅn(H2S)£ŗn(CH4)£½2£ŗ1£¬·¢Éś·“Ó¦£ŗCH4(g)£«2H2S(g)![]() CS2(g)£«4H2(g)”£0.1MPaŹ±£¬ĪĀ¶Č±ä»Æ¶ŌĘ½ŗāŹ±²śĪļµÄĪļÖŹµÄĮæ·ÖŹżµÄÓ°ĻģČēĶ¼ĖłŹ¾£ŗ
CS2(g)£«4H2(g)”£0.1MPaŹ±£¬ĪĀ¶Č±ä»Æ¶ŌĘ½ŗāŹ±²śĪļµÄĪļÖŹµÄĮæ·ÖŹżµÄÓ°ĻģČēĶ¼ĖłŹ¾£ŗ
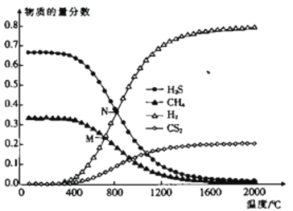
¢ŁøĆ·“Ó¦”÷H_________(Ģī”°>”±»ņ”°<”±)0”£
¢ŚMµć¶ŌÓ¦ĪĀ¶ČĻĀ£¬H2SµÄĘ½ŗā×Ŗ»ÆĀŹĪŖ_________£¬ĪŖĢįøßH2SµÄĘ½ŗā×Ŗ»ÆĀŹ£¬³żøıäĪĀ¶ČĶā£¬»¹æɲÉČ”µÄ“ėŹ©ŹĒ___________________________(ĮŠ¾ŁŅ»Ģõ)”£
¢ŪNµć£¬Ę½ŗā·ÖŃ¹p(CS2)£½_________MPa£¬¶ŌÓ¦ĪĀ¶ČĻĀ£¬øĆ·“Ó¦µÄKp£½_________(MPa)2”£(KpĪŖŅŌ·ÖŃ¹±ķŹ¾µÄĘ½ŗā³£Źż)
”¾“š°ø”æ5:16 AD -104 > 20% ¼õŠ”ĘšŹ¼Ź±![]()
![]()
![]()
”¾½āĪö”æ
£Ø1£©øł¾ŻĢāŅā£¬CS2±»Ńõ»ÆĪŖĮņĖįŃĪ£¬ĆæøöSµÄ»ÆŗĻ¼ŪÓÉ-2¼ŪÉżÖĮ+6¼Ū£¬×ŖŅʵē×ÓŹżĪŖ8£¬2øöS×ŖŅʵē×ÓŹżĪŖ16£¬MnO4£±»»¹ŌĪŖMn2£«£¬ĆæøöMn×ŖŅʵē×ÓŹżĪŖ5£¬øł¾ŻŃõ»Æ»¹Ō·“Ó¦×ŖŅʵē×ÓŹżŹŲŗć£¬»¹Ō¼Į£ØCS2£©ÓėŃõ»Æ¼Į£ØMnO4££©µÄĪļÖŹµÄĮæÖ®±ČĪŖ5:16£»
£Ø2£©¢ŁA£®vÕż(S2)£½2vÄę(CS2)£¬·“Ó¦ĖŁĀŹ·ūŗĻ»Æѧ¼ĘĮæŹżÖ®±Č£¬ĒŅ¼ČÓŠÕż·“Ó¦·½ĻņÓÖÓŠÄę·“Ó¦·½
Ļņ£¬AÕżČ·£»
B£®ĘųĢåµÄĆܶČ![]() £¬·“Ó¦ĪļŗĶÉś³ÉĪļ¶¼ŹĒĘųĢ壬øł¾ŻÖŹĮæŹŲŗć£¬mĪŖ¶ØÖµ£¬ČŻĘ÷Ģå»ż¹Ģ¶Ø£¬V²»±ä£¬¹Ź
£¬·“Ó¦ĪļŗĶÉś³ÉĪļ¶¼ŹĒĘųĢ壬øł¾ŻÖŹĮæŹŲŗć£¬mĪŖ¶ØÖµ£¬ČŻĘ÷Ģå»ż¹Ģ¶Ø£¬V²»±ä£¬¹Ź![]() ŹĒøö¶ØÖµ£¬²»ÄÜÓĆĄ“ÅŠ¶Ø»ÆŃ§Ę½ŗā£¬B“ķĪó£»
ŹĒøö¶ØÖµ£¬²»ÄÜÓĆĄ“ÅŠ¶Ø»ÆŃ§Ę½ŗā£¬B“ķĪó£»
C£®ÓÉÓŚ·“Ó¦CH4(g)£«2S2(g)![]() CS2(g)£«2H2S(g)Ē°ŗóĘųĢåĢå»ż²»±ä£¬¹ŹČŻĘ÷ÖŠµÄŃ¹ĒæŅ²²»±ä£¬ĖłŅŌŃ¹Ēæ²»ÄÜÓĆĄ“ÅŠ¶ØĘ½ŗā£¬C“ķĪó£»
CS2(g)£«2H2S(g)Ē°ŗóĘųĢåĢå»ż²»±ä£¬¹ŹČŻĘ÷ÖŠµÄŃ¹ĒæŅ²²»±ä£¬ĖłŅŌŃ¹Ēæ²»ÄÜÓĆĄ“ÅŠ¶ØĘ½ŗā£¬C“ķĪó£»
D£®¶ĻĮŃC£H¼üŹĒÕż·“Ó¦·½Ļņ£¬¶ĻĮŃH£S¼üŹĒÄę·“Ó¦·½Ļņ£¬CH4ÓėH2S¼ĘĮæŹżÖ®±ČĪŖ1:2£¬»Æѧ¼üŹżÄæÖ®±ČĪŖ1:1£¬µ„Ī»Ź±¼äÄŚ¶ĻĮŃC£H¼üŹżÄæÓė¶ĻĮŃH£S¼üŹżÄæĻąµČ£¬ĖµĆ÷·“Ó¦ĖŁĀŹ·ūŗĻĻµŹż±Č£¬DÕżČ·£»
¹ŹŃ”AD”£
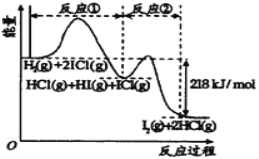
¢ŚģŹ±äæÉŅŌÓĆ·“Ó¦ĪļµÄ×ܼüÄܼõČ„Éś³ÉĪļµÄ×ܼüÄÜĄ“¼ĘĖć£¬![]() £»
£»
£Ø3£©¢ŁÓÉĶ¼ĻńæÉÖŖ£¬ĪĀ¶ČÉżøߏ±£¬Ę½ŗāĻņÕżĻņŅĘ¶Æ£¬¹ŹÕż·“Ó¦ĪüČČ£¬![]() >0£»
>0£»
¢ŚÉčæŖŹ¼Ź±Ķ¶ČėµÄCH4µÄĪļÖŹµÄĮæĪŖ![]() £¬H2SµÄĪļÖŹµÄĮæĪŖ2
£¬H2SµÄĪļÖŹµÄĮæĪŖ2![]() £¬·“Ó¦µÄCH4µÄĪļÖŹµÄĮæĪŖ
£¬·“Ó¦µÄCH4µÄĪļÖŹµÄĮæĪŖ![]() £¬ŌņÓŠ
£¬ŌņÓŠ
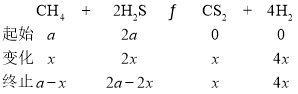
MµćŹ±£¬CH4ÓėH2SĪļÖŹµÄĮæĻąµČ£¬¹ŹÓŠ![]() £¬ŌņH2S×Ŗ»ÆĀŹĪŖ
£¬ŌņH2S×Ŗ»ÆĀŹĪŖ![]() £»Ōö“óH2SµÄ×Ŗ»ÆĀŹæÉŅŌĢįøßCH4µÄĶ¶ĮĻ±Č£¬¼“¼õŠ”ĘšŹ¼Ź±
£»Ōö“óH2SµÄ×Ŗ»ÆĀŹæÉŅŌĢįøßCH4µÄĶ¶ĮĻ±Č£¬¼“¼õŠ”ĘšŹ¼Ź±![]() £»
£»
¢ŪÉčæŖŹ¼Ź±Ķ¶ČėµÄCH4µÄĪļÖŹµÄĮæĪŖ![]() £¬H2SµÄĪļÖŹµÄĮæĪŖ2
£¬H2SµÄĪļÖŹµÄĮæĪŖ2![]() £¬·“Ó¦µÄCH4µÄĪļÖŹµÄĮæĪŖ
£¬·“Ó¦µÄCH4µÄĪļÖŹµÄĮæĪŖ![]() £¬ŌņÓŠ
£¬ŌņÓŠ
NµćŹ±£¬H2SÓėH2ĪļÖŹµÄĮæĻąµČ£¬¹ŹÓŠ![]() £¬½āµĆ
£¬½āµĆ![]() ”£ĖłŅŌ·“Ó¦ŗóµÄ×ÜĪļÖŹµÄĮæĪŖ
”£ĖłŅŌ·“Ó¦ŗóµÄ×ÜĪļÖŹµÄĮæĪŖ![]() £¬Ę½ŗāŗóCS2µÄ·ÖŃ¹ĪŖ
£¬Ę½ŗāŗóCS2µÄ·ÖŃ¹ĪŖ![]() £»
£»
Ę½ŗā³£Źż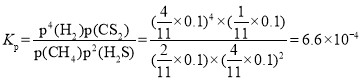 ”£
ӣ

 ŹÖĄŹÖČ«ÓÅĮ·æ¼¾ķĻµĮŠ“š°ø
ŹÖĄŹÖČ«ÓÅĮ·æ¼¾ķĻµĮŠ“š°ø”¾ĢāÄæ”æ“óĘųĪŪČ¾Ō½Ą“Ō½³ÉĪŖČĖĆĒ¹Ų×¢µÄĪŹĢā£¬ŃĢĘųÖŠµÄNOx±ŲŠėĶŃ³ż(¼“ĶŃĻõ)Ö®ŗó²ÅÄÜÅÅ·Å”£
£Ø1£©COŗĶH2æÉ×÷ĪŖÄÜŌ“ŗĶ»Æ¹¤ŌĮĻ£¬Ó¦ÓĆŹ®·Ö¹ć·ŗ”£ ·“Ó¦CO(g)£«H2O(g) ![]() H2(g)£«CO2(g)µÄĘ½ŗā³£ŹżĖęĪĀ¶ČµÄ±ä»ÆČē±ķĖłŹ¾”£
H2(g)£«CO2(g)µÄĘ½ŗā³£ŹżĖęĪĀ¶ČµÄ±ä»ÆČē±ķĖłŹ¾”£
ĪĀ¶Č/”ę | 400 | 500 | 830 | 1 000 |
Ę½ŗā³£ŹżK | 10 | 9 | 1 | 0.6 |
¢Ł“ÓÉĻ±ķæÉŅŌĶʶĻ£ŗ“Ė·“Ó¦ŹĒ__________(Ģī”°Īü”±»ņ”°·Å”±)ČČ·“Ó¦”£
¢ŚŌŚ830 ”ęĻĀ£¬ČōæŖŹ¼Ź±ĻņŗćČŻĆܱÕČŻĘ÷ÖŠ³äČėCOÓėH2O¾łĪŖ1 mol£¬Ōņ“ļµ½Ę½ŗāŗóCOµÄ×Ŗ»ÆĀŹĪŖ________”£
£Ø2£©ŌŚĘū³µĪ²ĘųĻµĶ³ÖŠ×°ÖĆ“ß»Æ×Ŗ»ÆĘ÷£¬æÉÓŠŠ§½µµĶNOxŗĶCOµÄÅÅ·Å”£
ŅŃÖŖ£ŗ¢Ł2CO(g)£«O2(g) ![]() 2CO2(g) ¦¤H£½566.0 kJ”¤mol1
2CO2(g) ¦¤H£½566.0 kJ”¤mol1
¢ŚN2(g)£«O2(g) ![]() 2NO(g) ¦¤H£½+180.5 kJ”¤mol1
2NO(g) ¦¤H£½+180.5 kJ”¤mol1
¢Ū2NO(g)£«O2(g) ![]() 2NO2(g) ¦¤H£½116.5 kJ”¤mol1
2NO2(g) ¦¤H£½116.5 kJ”¤mol1
»Ų“šĻĀĮŠĪŹĢā£ŗ
¢ŁCOµÄČ¼ÉÕČČĪŖ _________”£ Čō1 mol N2(g)”¢1 mol O2(g) ·Ö×ÓÖŠ»Æѧ¼ü¶ĻĮŃŹ±·Ö±šŠčŅŖĪüŹÕ946 kJ”¢498 kJµÄÄÜĮ棬Ōņ1 mol NO(g) ·Ö×ÓÖŠ»Æѧ¼ü¶ĻĮŃŹ±ŠčĪüŹÕµÄÄÜĮæĪŖ_________kJ”£
¢ŚŠ“³öCO½«NO2»¹ŌĪŖµ„ÖŹ·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ĪŖ__________________________________________
£Ø3£©Ęū³µÅÅĘų¹ÜÉĻµÄ“ß»Æ×Ŗ»ÆĘ÷£¬·¢ÉśÉĻŹöµÄCO½«NO2»¹ŌĪŖµ„ÖŹ·“Ó¦”£ŌŚŅ»¶ØĪĀ¶ČĻĀ£¬½«Ņ»¶ØĮæµÄCOŗĶNO2³äČė2L¹Ģ¶ØČŻ»żµÄČŻĘ÷ÖŠ£¬»Ų“šŅŌĻĀĪŹĢā£ŗ
¢Ł“Ó·“Ó¦æŖŹ¼µ½5min£¬Éś³ÉĮĖ0.08mol N2£¬Ōņ5minÄŚ¦Ō(CO)=___________________molL1min1”£
¢Ś25minŹ±£¬ĪļÖŹÅØ¶Č±ä»ÆČēĶ¼ĖłŹ¾£¬ŌņøıäµÄĢõ¼žæÉÄÜŹĒ___________(Ģī×ÖÄø±źŗÅ)”£
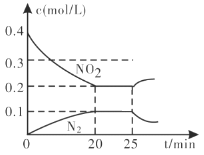
A.ĖõŠ”ČŻĘ÷Ģå»ż B.Ōö¼ÓNO2µÄÅØ¶Č C.½µµĶĪĀ¶Č D.ÉżøßĪĀ¶Č