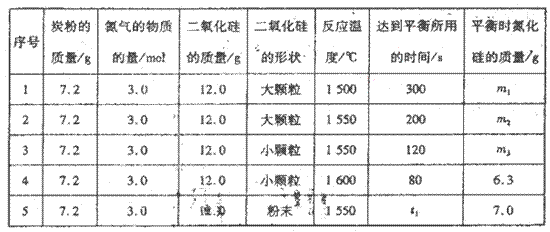
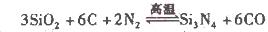题目内容
在CO跟O2的反应中,破坏1molCO中的化学键消耗的能量为A,破坏1molO=O键消耗的能量为B,形成1molC=O键释放的能量为C。则下列关系正确的是
A.2A+B>2C B.2A+B>4C C.2A + B < 2C D.2A + B < 4C
D
解析试题分析:反应热就是断键形成的能量和形成化学键所放出的能量的差值,CO燃烧是放热反应,则根据方程式2CO+O2=2CO2和物质的结构式可知,一定有2A+B<4C,答案选D。
考点:考查反应热的计算
点评:该题是基础性试题的考查,主要是考查学生对反应热与化学键键能关系的熟悉了解程度,有利于培养学生的逻辑思维能力和抽象思维能力。明确化学键键能与反应热的关系是答题的关键。

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
某一化学反应在不同条件下的能量变化曲线如图所示。下列说法正确的是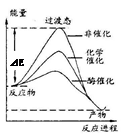
| A.化学催化比酶催化的效果好 |
| B.使用不同催化剂可以改变反应的热效应 |
| C.使用不同催化剂可以改变反应的能耗 |
| D.反应物的总能量低于生成物的总能量 |
下列说法错误的是
| A.化学反应除了生成新的物质外,还伴随着能量的变化 |
| B.物质的燃烧一定是放热反应 |
| C.放热的化学反应不需要加热就能发生 |
| D.化学能与光能之间可以相互转化 |
下列变化中生成物的总能量大于反应物的总能量的是( )
| A.H + H = H—H | B.H—Cl =" H" + Cl |
| C.Mg + 2HCl = MgCl2 + H2 ↑ | D.H2SO4 + 2NaOH = Na2SO4 + 2H2O |
下列反应中属吸热反应的是
| A.铝与盐酸反应放出氢气 | B.氢氧化钠与盐酸的反应 |
| C.硫在空气或氧气中燃烧 | D.Ba(OH)2·8H2O与NH4Cl反应 |
下列依据热化学方程式得出的结论正确的是
| A.已知2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ·mol-1,则氢气的燃烧热(△H)为—241.8 kJ·mol-1 |
| B.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ·mol-1,则含40.0g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3kJ的热量 |
| C.己知2C(s)+2O2(g)=2CO2(g)△H = a;2C(s)+O2(g)=2CO(g);△H = b,则a>b |
| D.已知C (石墨,s)="C" (金刚石,s)△H>0,则石墨比金刚石稳定 |
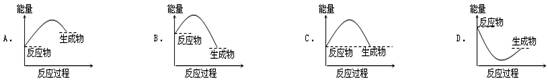
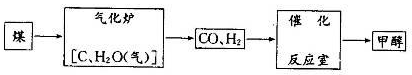
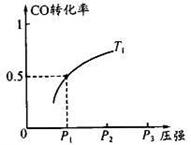
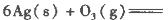
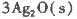 反应生成3 mol Ag2O(s)时放出的热量为
反应生成3 mol Ag2O(s)时放出的热量为
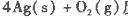 反应生成4 mol Ag(s)时吸收的热量为62.2 kJ,试根据题给数据判断O3转化为O2是________(填“放热”或“吸热”)反应。
反应生成4 mol Ag(s)时吸收的热量为62.2 kJ,试根据题给数据判断O3转化为O2是________(填“放热”或“吸热”)反应。