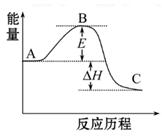
题目内容
下列说法错误的是
| A.化学反应除了生成新的物质外,还伴随着能量的变化 |
| B.物质的燃烧一定是放热反应 |
| C.放热的化学反应不需要加热就能发生 |
| D.化学能与光能之间可以相互转化 |
C
解析试题分析:化学反应除了生成新的物质外,还伴随着能量的变化,这是化学反应的特征,A正确;燃烧一定是放热反应,B正确;反应是放热反应还是吸热反应与反应条件无关系,C不正确;化学能与光能之间可以相互转化,例如次氯酸见光易分解等,D正确,答案选C。
考点:考查化学反应中的能量变化、化学反应的特征以及反应条件的判断
点评:该题是高考中的常见考点,属于基础性试题的考查,难度不大。明确反应热的含义以及影响反应热大小因素、化学反应的特征是答题的关键,注意相关知识的积累和总结,并能熟练记住和灵活运用即可。

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
下列关于燃烧热和中和热的比较中,错误的是
| A.两者对应反应的△H均小于0 |
| B.两者的单位均为kJ·mol-1,但mol-1的含义不同 |
| C.两者的数值均不随反应物用量改变而改变 |
| D.两者的数值均随反应物改变而改变 |
参照反应Br + H2 HBr +H的能量对反应历程的示意图,下列对上述正反应叙述中正确的
HBr +H的能量对反应历程的示意图,下列对上述正反应叙述中正确的 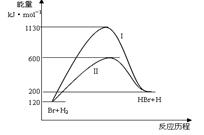
| A.反应热:过程I>过程Ⅱ |
| B.反应速率:过程Ⅱ=过程I |
| C.该反应为吸热反应 |
| D.过程I使用了催化剂 |
将20g Ba(OH) ·8H
·8H O晶体与10 g NH
O晶体与10 g NH Cl晶体一起放入小烧杯中,将烧杯放在滴有3~4滴水的玻璃片上,用玻璃棒迅速搅拌。则下列说法正确的是
Cl晶体一起放入小烧杯中,将烧杯放在滴有3~4滴水的玻璃片上,用玻璃棒迅速搅拌。则下列说法正确的是
| A.实验中玻璃棒的作用是加速固体溶解 |
| B.玻璃片上结冰而与小烧杯粘在一起,说明该反应是放热反应 |
| C.所取反应物质量的多少会影响反应是吸热,还是放热 |
| D.该反应中,反应物的总能量小于生成物的总能量 |
关于热化学方程式:2H2(g)+02(g)=2H20(1)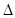 H=-571.6 kJ·mol-1,下列关叙述不正确的是 ( )
H=-571.6 kJ·mol-1,下列关叙述不正确的是 ( )
| A.2mol H2完全燃烧生成液态水放出571.6 kJ的热 |
| B.1mol H2完全燃烧生成液态水时放出285.8kJ的热 |
| C.2个氢分子完全燃烧生成液态水时放出571.6 kJ的热 |
D.上述热化学方程式可表示为H2(g)+1/2 O2(g)=H20(1),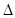 H=-285.8 kJ·mol-1 H=-285.8 kJ·mol-1 |
下列有关说法不正确的是:
A.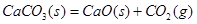 室温下不能自发进行,说明该反应的 室温下不能自发进行,说明该反应的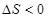 |
| B.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 |
C.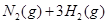  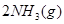 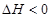 ,其他条件不变时升高温度,反应速率v(H2)和v(NH3)均增大 ,其他条件不变时升高温度,反应速率v(H2)和v(NH3)均增大 |
| D.水的离子积常数KW随着温度的升高而增大,说明水的电离是吸热过程 |
用H2O2和H2SO4的混合溶液可溶出废旧印刷电路板上的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) ΔH=+64.39kJ/mol
2H2O2(l)=2H2O(l)+O2(g) ΔH=-196.46kJ/mol
H2(g)+ O2(g)=H2O(l) ΔH=-285.84kJ/mol
O2(g)=H2O(l) ΔH=-285.84kJ/mol
在H2SO4溶液中,Cu与H2O2反应生成Cu2+(aq)和H2O(l)的反应热ΔH等于
| A.-417.91kJ·mol-1 | B.-319.68 kJ·mol-1 |
| C.+546.69 kJ·mol-1 | D.-448.46 kJ·mol-1 |
 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH="-99" kJ·mol-1
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH="-99" kJ·mol-1