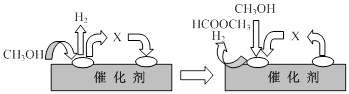
题目内容
下列变化中生成物的总能量大于反应物的总能量的是( )
| A.H + H = H—H | B.H—Cl =" H" + Cl |
| C.Mg + 2HCl = MgCl2 + H2 ↑ | D.H2SO4 + 2NaOH = Na2SO4 + 2H2O |
B
解析试题分析:氢原子结合生成氢气的过程放出能量,因此反应物的总能量高于生成物的总能量,A不正确;氯化氢分子变为氯原子和氢原子的过程,需要吸热,则生成物的总能量大于反应物的总能量,B正确;选项C、D中的化学反应均是放热反应,反应物的总能量高于生成物的总能量,均不符合题意,答案选B。
考点:考查反应热的判断和应用
点评: 该题是常识性知识的考查,侧重对学生基础知识的巩固和检验。明确断键吸热和形成化学键放热以及熟练记住常见的放热反应和吸热反应是答题的关键,难度不大。

已知: (1)NH3(g)+HCl(g)=NH4Cl(s); △H1=-76kJ·mol-1
(2)NH3(g)+H2O(l)=NH3·H2O(aq); △H2=-35.1kJ·mol-1
(3)HCl(g)+HCl (aq); △H3=-72.3kJ·mol-1
(4)HCl (aq) NH3·H2O(aq) =NH4Cl(aq)+H2O(l); △H4=-52.3kJ·mol-1
(5)NH4Cl(s)=NH2Cl(aq); △H5=?
根据盖斯定律,则(5)方程式中的反应热△H5为
| A.-335.7 kJ·mol-1 | B.-16.3 kJ·mol-1 |
| C.+16.3 kJ·mol-1 | D.-83.7 kJ·mol-1 |
下列说法不正确的是
A.水解反应NH4++H2O NH3·H2O+H+达到平衡后,升高温度平衡正向移动 NH3·H2O+H+达到平衡后,升高温度平衡正向移动 |
| B.在海轮的外壳上镶入锌块,可减缓船体的腐蚀速率 |
| C.明矾水解生成Al(OH)3胶体,可用作净水剂 |
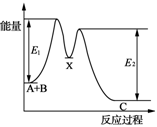
| D.如图所示的反应过程中A+B→X的△H<0,X→C的△H>0 |
将20g Ba(OH) ·8H
·8H O晶体与10 g NH
O晶体与10 g NH Cl晶体一起放入小烧杯中,将烧杯放在滴有3~4滴水的玻璃片上,用玻璃棒迅速搅拌。则下列说法正确的是
Cl晶体一起放入小烧杯中,将烧杯放在滴有3~4滴水的玻璃片上,用玻璃棒迅速搅拌。则下列说法正确的是
| A.实验中玻璃棒的作用是加速固体溶解 |
| B.玻璃片上结冰而与小烧杯粘在一起,说明该反应是放热反应 |
| C.所取反应物质量的多少会影响反应是吸热,还是放热 |
| D.该反应中,反应物的总能量小于生成物的总能量 |
下列各组中的两种物质作用,反应条件(温度或者反应物用量)改变,不会引起产物种类改变的是( )
| A.Na和O2 | B.NaOH和CO2 |
| C.Na2O2和CO2 | D.AlCl3和NaOH |
下列反应既是氧化还原反应,又是吸热反应的是( )
| A.铝片与稀H2SO4的反应 | B.Ba(OH)2·8H2O与NH4Cl的反应 |
| C.灼热的炭与CO2的反应 | D.甲烷在O2中的燃烧反应 |
已知反应A2(g)+B2(g)=2AB(g),断开1molA2中的化学键消耗的能量为Q1 kJ,断开1molB2中的化学键消耗的能量为Q2 kJ,生成1molAB中的化学键释放的能量为Q3kJ(Q1、Q2、Q3均大于零),则下列说法正确的是 ( )
| A.若A2和B2的总能量之和大于生成的2AB的总能量,则反应放热 |
| B.若A2和B2的总能量之和小于生成的2AB的总能量,则反应放热 |
| C.若该反应为放热反应,则Q1+Q2 < Q3 |
| D.若该反应为吸热反应,则Q1+Q2 < Q3 |
 HCOOCH3(g)+2H2(g) △H>0
HCOOCH3(g)+2H2(g) △H>0