题目内容
下列各图中能表示 A(g)+B(g)===C(g)+D(l)是放热反应的是(E表示能量) 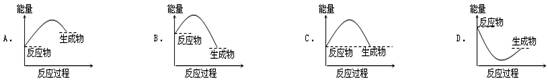
B
解析试题分析:如果反应物的总能量高于生成物的总能量,则反应是放热反应,反之是吸热反应。A中反应物的总能量低于生成物的总能量,是吸热反应;B中反应物的总能量高于生成物的总能量,是放热反应;C中反应物的总能量等于生成物的总能量,不符合客观事实,不正确;D中反应的过程不符合客观事实,不正确,答案选B。
考点:考查放热反应和吸热反应的判断
点评:该题是基础性试题的考查,难度不大。该题的关键是明确放热反应或吸热反应与反应物总能量与生成物总能量相对大小的关系,然后结合题意和图像灵活运用即可。易错点是选项D。

练习册系列答案
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案
相关题目
参照反应Br + H2 HBr +H的能量对反应历程的示意图,下列对上述正反应叙述中正确的
HBr +H的能量对反应历程的示意图,下列对上述正反应叙述中正确的 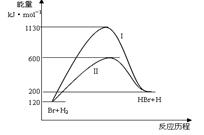
| A.反应热:过程I>过程Ⅱ |
| B.反应速率:过程Ⅱ=过程I |
| C.该反应为吸热反应 |
| D.过程I使用了催化剂 |
关于热化学方程式:2H2(g)+02(g)=2H20(1)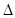 H=-571.6 kJ·mol-1,下列关叙述不正确的是 ( )
H=-571.6 kJ·mol-1,下列关叙述不正确的是 ( )
| A.2mol H2完全燃烧生成液态水放出571.6 kJ的热 |
| B.1mol H2完全燃烧生成液态水时放出285.8kJ的热 |
| C.2个氢分子完全燃烧生成液态水时放出571.6 kJ的热 |
D.上述热化学方程式可表示为H2(g)+1/2 O2(g)=H20(1),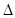 H=-285.8 kJ·mol-1 H=-285.8 kJ·mol-1 |
下列说法中不正确的是
| A.与煤油、柴油相比较,天然气是一种比较清洁的化石燃料 |
| B.乙醇是一种可再生能源,作为燃料的优点的是完全燃烧的产物不污染环境 |
| C.利用太阳能、风能和氢能等能源替代化石能源能有效改善空气质量 |
| D.煤的气化和液化不仅可以获得洁净燃料,而且再燃烧会放出更多的热量 |
下列有关说法不正确的是:
A.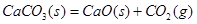 室温下不能自发进行,说明该反应的 室温下不能自发进行,说明该反应的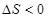 |
| B.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 |
C.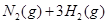  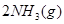 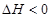 ,其他条件不变时升高温度,反应速率v(H2)和v(NH3)均增大 ,其他条件不变时升高温度,反应速率v(H2)和v(NH3)均增大 |
| D.水的离子积常数KW随着温度的升高而增大,说明水的电离是吸热过程 |
(15分)碳和氮的化合物与人类生产、生活密切相关。
(1)在一恒温、恒容密闭容器中发生反应: Ni(s)+4CO(g) 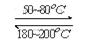 Ni(CO)4(g),
Ni(CO)4(g), H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是
H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是
(填字母编号)。
| A.增加Ni的量可提高CO的转化率,Ni的转化率降低 |
B.缩小容器容积,平衡右移, H减小 H减小 |
| C.反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低 |
| D.当4vNi(CO)4=v(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态 |
已知:C(s)+
 O2(g)==CO(g)
O2(g)==CO(g)  H= -Q1 kJ·mol-1
H= -Q1 kJ·mol-1C(s)+ O2(g)==CO2(g)
 H= -Q2 kJ·mol-1
H= -Q2 kJ·mol-1S(s)+O2(g)==SO2(g)
 H= -Q3 KJ·mol-1
H= -Q3 KJ·mol-1则SO2(g)+2CO(g)==S(s)+2CO2(g)
 H= kJ·mol-1。
H= kJ·mol-1。(3)金属氧化物可被一氧化碳还原生成金属单质和二氧化碳。图(1)是四种金属氧化物(Cr2O3、SnO2、PbO2、Cu2O)被一氧化碳还原时
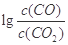 与温度(t)的关系曲线图。
与温度(t)的关系曲线图。700oC时,其中最难被还原的金属氧化物是 (填化学式),用一氧化碳还原该金属氧化物时,若反应方程式系数为最简整数比,该反应的平衡常数(K)数值等于 。

(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如上图(2)所示。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为 。
若该燃料电池使用一段时间后,共收集到20mol Y,则理论上需要消耗标准状况下氧气的体积为 L。

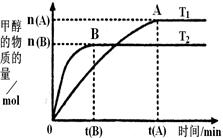
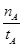 mol·L-1·min-1
mol·L-1·min-1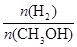 增大
增大