题目内容
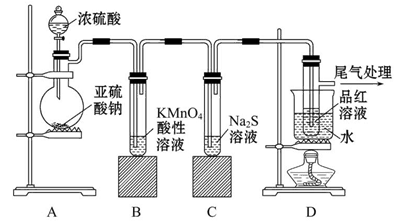
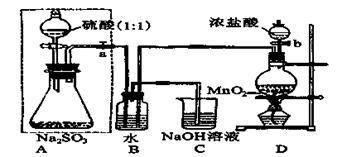
研究性学习小组用Na2SO3与硫酸溶液(硫酸与水体积比1∶1)制备SO2并进行性质探究实验。

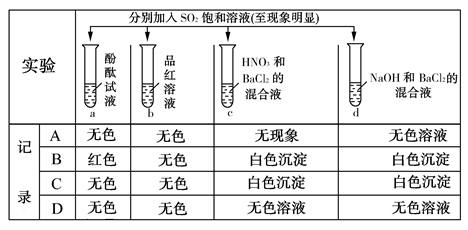
(1)D中的实验现象是 ,C、E中溶液都褪色,分别体现SO2 、 性质。
(2)请在方框中画出收集SO2以及尾气处理装置(标相关试剂)。
(3)研究小组发现B中有白色沉淀,为了清楚沉淀的物质,研究小组往B中加入过量稀盐酸,沉淀不溶解,你认为留下的沉淀物是 ,形成该沉淀的反应方程式有: 。
为了进一步验证沉淀原因,研究小组另取BaC12溶液,加热煮沸,冷却及时加入少量苯液封,然后再通SO2,结果发现沉淀量减少,但仍有轻微浑浊。研究小组改进A装置(如右图),再进行实验,B中没有出现浑浊。下列气体可作为X气体的是 (填序号,不定项选择)

A.CO2 B.NH3 C.O3 D.N2 E.NO2
(4)SO2为空气污染物,研究小组为测定某工厂区空气中SO2的含量,取10m3(标准状况)的空气,缓慢通过足量溴水中,在所得溶液中加入过量的BaC12溶液,将产生的白色沉淀洗涤、干燥,用电子称称其质量为0.233g,则:
①沉淀洗涤要干净,检验洗涤已经干净的实验操作是 。
②试计算此空气中SO2的浓度(列出计算表达式并计算结果,结果单位用mg/m3表示)。

(1)D中的实验现象是 ,C、E中溶液都褪色,分别体现SO2 、 性质。
(2)请在方框中画出收集SO2以及尾气处理装置(标相关试剂)。
(3)研究小组发现B中有白色沉淀,为了清楚沉淀的物质,研究小组往B中加入过量稀盐酸,沉淀不溶解,你认为留下的沉淀物是 ,形成该沉淀的反应方程式有: 。
为了进一步验证沉淀原因,研究小组另取BaC12溶液,加热煮沸,冷却及时加入少量苯液封,然后再通SO2,结果发现沉淀量减少,但仍有轻微浑浊。研究小组改进A装置(如右图),再进行实验,B中没有出现浑浊。下列气体可作为X气体的是 (填序号,不定项选择)

A.CO2 B.NH3 C.O3 D.N2 E.NO2
(4)SO2为空气污染物,研究小组为测定某工厂区空气中SO2的含量,取10m3(标准状况)的空气,缓慢通过足量溴水中,在所得溶液中加入过量的BaC12溶液,将产生的白色沉淀洗涤、干燥,用电子称称其质量为0.233g,则:
①沉淀洗涤要干净,检验洗涤已经干净的实验操作是 。
②试计算此空气中SO2的浓度(列出计算表达式并计算结果,结果单位用mg/m3表示)。
(1)出现淡黄色浑浊(或淡黄色沉淀或有淡黄色固体产生)(每空2分) 漂白性、还原性(各1分,共2分)
(2) (2分,只画收集装置0分,没标注或标澄清石灰水扣1分)
(2分,只画收集装置0分,没标注或标澄清石灰水扣1分)
(3)BaSO4(2分) SO2+H2O H2SO3、 2H2SO3+O2=2H2SO4、 H2SO4+BaCl2=BaSO4↓+2HCl(每个1分,共3分) AD(2分)
H2SO3、 2H2SO3+O2=2H2SO4、 H2SO4+BaCl2=BaSO4↓+2HCl(每个1分,共3分) AD(2分)
(4)①取最后一次洗涤液少量于试管中,加入硝酸酸化的AgNO3溶液,没有明显现象,证明洗涤干净(2分)
②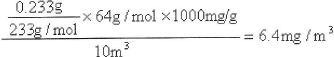 (2分,列式1分,结果1分)
(2分,列式1分,结果1分)
(2)
 (2分,只画收集装置0分,没标注或标澄清石灰水扣1分)
(2分,只画收集装置0分,没标注或标澄清石灰水扣1分)(3)BaSO4(2分) SO2+H2O
 H2SO3、 2H2SO3+O2=2H2SO4、 H2SO4+BaCl2=BaSO4↓+2HCl(每个1分,共3分) AD(2分)
H2SO3、 2H2SO3+O2=2H2SO4、 H2SO4+BaCl2=BaSO4↓+2HCl(每个1分,共3分) AD(2分)(4)①取最后一次洗涤液少量于试管中,加入硝酸酸化的AgNO3溶液,没有明显现象,证明洗涤干净(2分)
②
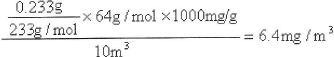 (2分,列式1分,结果1分)
(2分,列式1分,结果1分)试题分析:(1)SO2+2H2S==3S↓+2H2O,则D中出现淡黄色浑浊(或淡黄色沉淀或有淡黄色固体产生);使品红溶液褪色体现了SO2的漂白性,使酸性高锰酸钾溶液褪色体现了SO2的还原性;(2)SO2易溶于水、密度比空气、有毒,因此常用向上排空气法或长进短出法收集,用NaOH溶液吸收多余的SO2;(3)BaSO3、BaSO4均为难溶物,前者能溶于盐酸,后者难溶于盐酸;SO2+H2O
 H2SO3、 2H2SO3+O2=2H2SO4、 H2SO4+BaCl2=BaSO4↓+2HCl;改进的目的是防止空气中的氧气氧化SO2、H2SO3,因此常通入CO2、N2驱赶装置中的氧气;(4)沉淀具有吸附性,BaSO4沉淀吸附了BaCl2,因此取最后一次洗涤液少量于试管中,加入硝酸酸化的AgNO3溶液,没有明显现象,证明洗涤干净;由m/M可知,n(BaSO4)=
H2SO3、 2H2SO3+O2=2H2SO4、 H2SO4+BaCl2=BaSO4↓+2HCl;改进的目的是防止空气中的氧气氧化SO2、H2SO3,因此常通入CO2、N2驱赶装置中的氧气;(4)沉淀具有吸附性,BaSO4沉淀吸附了BaCl2,因此取最后一次洗涤液少量于试管中,加入硝酸酸化的AgNO3溶液,没有明显现象,证明洗涤干净;由m/M可知,n(BaSO4)= ;由硫元素守恒可知,n(SO2)=n(BaSO4)=
;由硫元素守恒可知,n(SO2)=n(BaSO4)= ;由n?M可知,m(SO2)=
;由n?M可知,m(SO2)= ×64gmol—1=
×64gmol—1= ×64gmol—1×1000mg/g;则题给空气中SO2的浓度为
×64gmol—1×1000mg/g;则题给空气中SO2的浓度为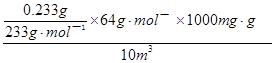 =6.4mg?m—3。
=6.4mg?m—3。
练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目