题目内容
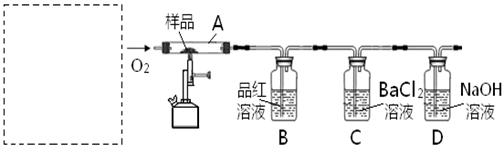
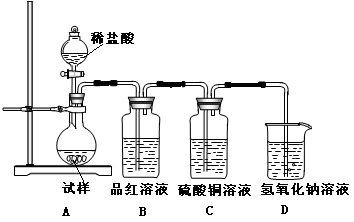
长期存放的亚硫酸钠可能会被空气中的氧气氧化。某化学兴趣小组通过实验来测定亚硫酸钠试剂被氧化的程度,设计了下图实验,请回答下面的问题:
(1)D装置中反应的化学方程式为 。
B装置中反应的离子方程为 。
(2)称量ag Na2SO3样品放入锥形瓶中,向B装置反应后的溶液中加入足量的BaCl2溶液充分反应、过滤、洗涤、干燥,得白色沉淀bg,原样品中Na2SO3的质量分为数为: 。
(3)为保证实验测定的准确性,A中的硫酸什么时候滴加 ,
C装置中NaOH溶液的作用是 _________________。
(4)现有以下试剂:①蒸馏水、②稀盐酸、③稀硝酸、④BaCl2溶液、⑤Ba(NO3)2溶液,请从中选择合适试剂,设计一种不同的实验方法,测定试样中无水亚硫酸钠被氧化的程度,你使用试剂的顺序为: 。(填试剂编号)

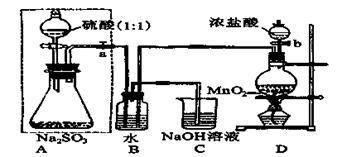
(1)D装置中反应的化学方程式为 。
B装置中反应的离子方程为 。
(2)称量ag Na2SO3样品放入锥形瓶中,向B装置反应后的溶液中加入足量的BaCl2溶液充分反应、过滤、洗涤、干燥,得白色沉淀bg,原样品中Na2SO3的质量分为数为: 。
(3)为保证实验测定的准确性,A中的硫酸什么时候滴加 ,
C装置中NaOH溶液的作用是 _________________。
(4)现有以下试剂:①蒸馏水、②稀盐酸、③稀硝酸、④BaCl2溶液、⑤Ba(NO3)2溶液,请从中选择合适试剂,设计一种不同的实验方法,测定试样中无水亚硫酸钠被氧化的程度,你使用试剂的顺序为: 。(填试剂编号)
(1)MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O (3分) Cl2+SO2+2H2O==4H++2Cl-+SO42- (3分)
MnCl2+Cl2↑+2H2O (3分) Cl2+SO2+2H2O==4H++2Cl-+SO42- (3分)
(2)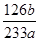 ×100% (2分)
×100% (2分)
(3)待B中水面上方充满了黄绿色的气体(2分) 吸收尾气,防止污染大气 (2分)
(4)①②④ (3分)
 MnCl2+Cl2↑+2H2O (3分) Cl2+SO2+2H2O==4H++2Cl-+SO42- (3分)
MnCl2+Cl2↑+2H2O (3分) Cl2+SO2+2H2O==4H++2Cl-+SO42- (3分)(2)
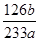 ×100% (2分)
×100% (2分)(3)待B中水面上方充满了黄绿色的气体(2分) 吸收尾气,防止污染大气 (2分)
(4)①②④ (3分)
试题分析:(1)D为实验室制备氯气的发生装置,反应为:MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O;氯气具有氧化性,二氧化硫具有还原性,在B中发生氧化还原反应生成盐酸和硫酸,反应为:Cl2+SO2+2H2O═4H++2Cl-+SO42-。
MnCl2+Cl2↑+2H2O;氯气具有氧化性,二氧化硫具有还原性,在B中发生氧化还原反应生成盐酸和硫酸,反应为:Cl2+SO2+2H2O═4H++2Cl-+SO42-。(2)根据硫元素守恒计算,得到的bg沉淀是BaSO4,根据Na2SO3—SO2—BaSO4,可知Na2SO3为
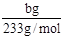 =
= 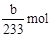 ,所以Na2SO3的质量分为数为
,所以Na2SO3的质量分为数为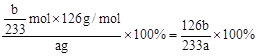 。
。(3)保证实验的准确性就是不让SO2流失掉,所以硫酸应该在B中水面上方充满了黄绿色的气体的时候滴加;C中的NaOH溶液的作用是吸收尾气,防止氯气污染大气。
(4))另外一种设计方案是将Na2SO3溶于水,然后向其中加入稀盐酸至不再产生气体为止,在加BaCl2溶液,然后将生成的沉淀过滤洗涤干燥称量其质量,求出Na2SO4的质量分数,继而求得Na2SO3的质量分数。所以使用试剂的顺序是①②④。

练习册系列答案
相关题目


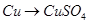
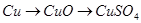

 ,该反应中被氧化的元素是________(填元素符号)。
,该反应中被氧化的元素是________(填元素符号)。
 CaO+CO2 ㈡ 2CaO+2SO2+O2 =2CaSO4
CaO+CO2 ㈡ 2CaO+2SO2+O2 =2CaSO4