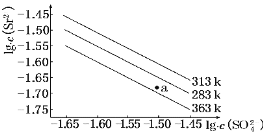
��Ŀ����
����Ŀ����֪��100 �桢1.01��105 Pa�£�1 mol������������ȼ��������̬ˮ�������仯��ͼ��ʾ�������й�˵������ȷ����(����)
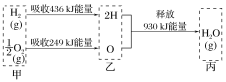
A.1 mol H2O(g)�ֽ�Ϊ2 mol H��1 mol Oʱ����930 kJ����
B.�Ȼ�ѧ����ʽΪ��2H2(g)��O2(g)=2H2O(g)����H����490 kJ��mol��1
C.�ס��ҡ��������������е���������С��ϵΪ��>��>��
D.�������Ĺ�����������Һ̬ˮ���ͷŵ�������С��930 kJ
���𰸡�D
��������
A. ����֪�������仯ͼ��֪��1 mol H2O(g)�ֽ�Ϊ2 mol H��1 mol Oʱ����930 kJ������A����ȷ��
B. ����֪�������仯ͼ��֪��H2(g)��![]() O2(g)=H2O(g) ��H����Ӧ��ϼ����յ�����-������ɼ��ͷŵ�����=(436+249-930)kJ��mol��1=-245kJ��mol��1�����Ȼ�ѧ����ʽΪ��2H2(g)��O2(g)=2H2O(g) ��H��-245kJ��mol��1��2=-490 kJ��mol��1��B����ȷ��
O2(g)=H2O(g) ��H����Ӧ��ϼ����յ�����-������ɼ��ͷŵ�����=(436+249-930)kJ��mol��1=-245kJ��mol��1�����Ȼ�ѧ����ʽΪ��2H2(g)��O2(g)=2H2O(g) ��H��-245kJ��mol��1��2=-490 kJ��mol��1��B����ȷ��
C. ���������������ң����ͷ��������ɱ����ҵ�������ߣ������ɱ�Ϊ���ȷ�Ӧ������������ڱ�����ס��ҡ��������������е���������С��ϵΪ������������C����ȷ��
D. �������Ĺ�����������̬ˮʱ���ͷ�930 kJ��������������Һ̬ˮ����̬ˮת��ΪҺ̬ˮ������ͷ����������ͷŵ�����������930 kJ��D�����
��ѡD��

����Ŀ��̽�����ᣨH2C2O4�����ʣ���������ʵ�顣����֪�������£�0.1 mol��L1 H2C2O4��pH=1.3��
ʵ�� | װ�� | �Լ�a | ���� |
�� |
| Ca(OH)2��Һ������̪�� | ��Һ��ɫ��������ɫ���� |
�� | ����NaHCO3��Һ | �������� | |
�� | ����KMnO4��Һ | ��ɫ��Һ��ɫ | |
�� | C2H5OH��Ũ���� | ���Ⱥ��������ζ���� |
������ʵ�����ò�����������Ӧ�ķ���ʽ����ȷ����
A. H2C2O4�����ԣ�Ca(OH)2+ H2C2O4![]() CaC2O4��+2H2O
CaC2O4��+2H2O
B. ���ԣ�H2C2O4> H2CO3��NaHCO3+ H2C2O4![]() NaHC2O4+CO2��+H2O
NaHC2O4+CO2��+H2O
C. H2C2O4���л�ԭ�ԣ�2![]() +5
+5![]() +16H+
+16H+![]() 2Mn2++10CO2��+ 8H2O
2Mn2++10CO2��+ 8H2O
D. H2C2O4�ɷ���������Ӧ��HOOCCOOH+2C2H5OH![]() C2H5OOCCOOC2H5+2H2O
C2H5OOCCOOC2H5+2H2O