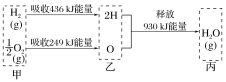
题目内容
【题目】某结晶水合物含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的三种离子,实验小组为确定其化学式做了如下实验:
中的三种离子,实验小组为确定其化学式做了如下实验:
![]() 准确称取
准确称取![]() 样品,配制成
样品,配制成![]() 溶液X。
溶液X。
![]() 取
取![]() 溶液X,加入足量盐酸,无明显现象;再加足量
溶液X,加入足量盐酸,无明显现象;再加足量![]() 溶液,产生白色沉淀;将沉淀过滤、洗涤、干燥至恒重,得白色固体
溶液,产生白色沉淀;将沉淀过滤、洗涤、干燥至恒重,得白色固体![]() 。
。
![]() 取
取![]() 溶液X,加入适量稀硫酸酸化后,用
溶液X,加入适量稀硫酸酸化后,用![]() 溶液滴定至终点,重复滴定三次,测得消耗
溶液滴定至终点,重复滴定三次,测得消耗![]() 溶液体积的平均值为
溶液体积的平均值为![]() 。
。
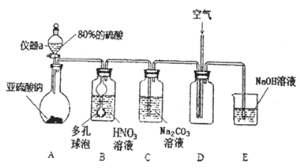
![]() 设计如图所示的装置,取
设计如图所示的装置,取![]() 溶液Ⅹ进行实验,实验前后B装置增重
溶液Ⅹ进行实验,实验前后B装置增重![]() 。
。
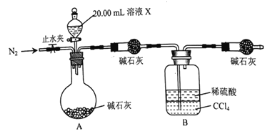
![]() 取少量溶液X,滴加
取少量溶液X,滴加![]() 溶液无明显现象,再向其中滴加
溶液无明显现象,再向其中滴加![]() 溶液,有白色沉淀生成。
溶液,有白色沉淀生成。
回答下列问题;
![]() 完成实验
完成实验![]() 所需要的玻璃仪器有;烧杯、玻璃棒、量筒、____________。
所需要的玻璃仪器有;烧杯、玻璃棒、量筒、____________。
![]() 实验
实验![]() 达到滴定终点的现象是_____________________。
达到滴定终点的现象是_____________________。
![]() 实验
实验![]() 的反应结束后,打开止水夹通入
的反应结束后,打开止水夹通入![]() 的作用是________________。
的作用是________________。
![]() 根据以上实验数据计算该结晶水合物的化学式为______________。
根据以上实验数据计算该结晶水合物的化学式为______________。
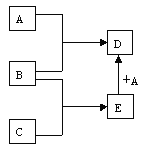
![]() 某同学查阅资料发现 AgSCN为白色难溶物,
某同学查阅资料发现 AgSCN为白色难溶物,![]() 可以氧化
可以氧化![]() 和
和![]() 。为探究
。为探究![]() 和
和![]() 的还原性强弱,该同学设计了如图实验装置并进行下列实验。
的还原性强弱,该同学设计了如图实验装置并进行下列实验。
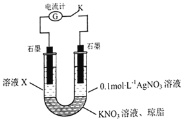
先断开电键K,向溶液X中滴加![]() 溶液,无明显现象,说明_____________;闭合电键K后,若观察到的实验现象有溶液X逐渐变红、右边石墨电极上有固体析出、电流计指针偏转,据此得出的结论是_____________,溶液变红的原因是___________
溶液,无明显现象,说明_____________;闭合电键K后,若观察到的实验现象有溶液X逐渐变红、右边石墨电极上有固体析出、电流计指针偏转,据此得出的结论是_____________,溶液变红的原因是___________![]() 用离子方程式表示
用离子方程式表示![]() ,该实验设计的优点是_______________。
,该实验设计的优点是_______________。
【答案】.![]() 容量瓶、胶头滴管 当最后一滴
容量瓶、胶头滴管 当最后一滴![]() 标准溶液滴入时,溶液颜色变为浅紫红色,且半分钟内不再发生变化 使锥形瓶中产生的氨气完全进入B装置中被稀硫酸吸收
标准溶液滴入时,溶液颜色变为浅紫红色,且半分钟内不再发生变化 使锥形瓶中产生的氨气完全进入B装置中被稀硫酸吸收 ![]() 溶液中无
溶液中无![]()
![]() 的还原性强于
的还原性强于![]()
![]() 氧化性、还原性离子不直接接触,避免发生沉淀反应而导致离子浓度降低
氧化性、还原性离子不直接接触,避免发生沉淀反应而导致离子浓度降低
【解析】
![]() 配制成
配制成![]() 溶液X需要的玻璃仪器有:烧杯、玻璃棒、量筒、250mL容量瓶、胶头滴管;
溶液X需要的玻璃仪器有:烧杯、玻璃棒、量筒、250mL容量瓶、胶头滴管;
![]() 达到滴定终点的现象是溶液颜色变为浅紫红色;
达到滴定终点的现象是溶液颜色变为浅紫红色;
![]() 打开止水夹通入
打开止水夹通入![]() 的作用是使锥形瓶中产生的氨气完全进入B装置中被稀硫酸吸收;
的作用是使锥形瓶中产生的氨气完全进入B装置中被稀硫酸吸收;
![]() 加入足量盐酸,无明显现象;再加足量
加入足量盐酸,无明显现象;再加足量![]() 溶液,产生白色沉淀硫酸钡
溶液,产生白色沉淀硫酸钡![]() ,硫酸钡的物质的量为
,硫酸钡的物质的量为![]() ,
,![]() ,由
,由![]() 知,
知,![]() ,由
,由![]() 知,实验前后B装置增重
知,实验前后B装置增重![]() ,则生成的氨气的物质的量为
,则生成的氨气的物质的量为![]() ,水的质量为
,水的质量为![]() ,物质的量为
,物质的量为![]() ,从而求出四种微粒的个数比,最后得出化学式;
,从而求出四种微粒的个数比,最后得出化学式;
![]() 溶液遇到
溶液遇到![]() 溶液呈红色,向溶液X中滴加
溶液呈红色,向溶液X中滴加![]() 溶液,无明显现象,说明溶液中无
溶液,无明显现象,说明溶液中无![]() ,观察到的实验现象有溶液X逐渐变红、右边石墨电极上有固体析出、电流计指针偏转,据此得出的结论是
,观察到的实验现象有溶液X逐渐变红、右边石墨电极上有固体析出、电流计指针偏转,据此得出的结论是![]() 的还原性强,生成的Fe3+与SCN-溶液作用使溶液变红,该实验设计的优点是氧化性、还原性离子不直接接触,避免发生沉淀反应而导致离子浓度降低。
的还原性强,生成的Fe3+与SCN-溶液作用使溶液变红,该实验设计的优点是氧化性、还原性离子不直接接触,避免发生沉淀反应而导致离子浓度降低。
![]() 配制成
配制成![]() 溶液X需要的玻璃仪器有:烧杯、玻璃棒、量筒、250mL容量瓶、胶头滴管,故答案为:250mL容量瓶、胶头滴管;
溶液X需要的玻璃仪器有:烧杯、玻璃棒、量筒、250mL容量瓶、胶头滴管,故答案为:250mL容量瓶、胶头滴管;
![]() 达到滴定终点的现象是当最后一滴
达到滴定终点的现象是当最后一滴![]() 标准溶液滴入时,溶液颜色变为浅紫红色,且半分钟内不再发生变化,故答案为:当最后一滴
标准溶液滴入时,溶液颜色变为浅紫红色,且半分钟内不再发生变化,故答案为:当最后一滴![]() 标准溶液滴入时,溶液颜色变为浅紫红色,且半分钟内不再发生变化;
标准溶液滴入时,溶液颜色变为浅紫红色,且半分钟内不再发生变化;
![]() 打开止水夹通入
打开止水夹通入![]() 的作用是使锥形瓶中产生的氨气完全进入B装置中被稀硫酸吸收,故答案为:使锥形瓶中产生的氨气完全进入B装置中被稀硫酸吸收;
的作用是使锥形瓶中产生的氨气完全进入B装置中被稀硫酸吸收,故答案为:使锥形瓶中产生的氨气完全进入B装置中被稀硫酸吸收;
![]() 加入足量盐酸,无明显现象;再加足量
加入足量盐酸,无明显现象;再加足量![]() 溶液,产生白色沉淀硫酸钡
溶液,产生白色沉淀硫酸钡![]() ,硫酸钡的物质的量为
,硫酸钡的物质的量为![]() ,
,![]() ,由
,由![]() 知,
知,![]() ,由
,由![]() 知,实验前后B装置增重
知,实验前后B装置增重![]() ,则生成的氨气的物质的量为
,则生成的氨气的物质的量为![]() ,水的质量为
,水的质量为![]() ,物质的量为
,物质的量为![]() ,则
,则![]() :
:![]() :
:![]() :
:![]() ,所以结晶水合物的化学式为
,所以结晶水合物的化学式为![]() ,故答案为:
,故答案为:![]() ;
;
![]() 溶液遇到
溶液遇到![]() 溶液呈红色,向溶液X中滴加
溶液呈红色,向溶液X中滴加![]() 溶液,无明显现象,说明溶液中无
溶液,无明显现象,说明溶液中无![]() ,观察到的实验现象有溶液X逐渐变红、右边石墨电极上有固体析出、电流计指针偏转,据此得出的结论是
,观察到的实验现象有溶液X逐渐变红、右边石墨电极上有固体析出、电流计指针偏转,据此得出的结论是![]() 的还原性强于SCN-,溶液变红的原因是
的还原性强于SCN-,溶液变红的原因是![]() ,该实验设计的优点是氧化性、还原性离子不直接接触,避免发生沉淀反应而导致离子浓度降低,故答案为:溶液中无
,该实验设计的优点是氧化性、还原性离子不直接接触,避免发生沉淀反应而导致离子浓度降低,故答案为:溶液中无![]() ;
;![]() 的还原性强于
的还原性强于![]() ;
;![]() ;氧化性、还原性离子不直接接触,避免发生沉淀反应而导致离子浓度降低。
;氧化性、还原性离子不直接接触,避免发生沉淀反应而导致离子浓度降低。

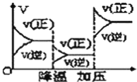
【题目】根据相应的图象(图象编号与答案一一对应),判断下列相关说法正确的是( )
选项 | A | B | C | D |
图像 |
|
|
|
|
反应 | aX(g)+bY(g)cZ(g) | L(s)+aG(g)bR(g) | aA+bBcC | A+2B2C+3D |
操作或条件 | 密闭容器中反应达到平衡,T0时改变某一条件有如图变化所示,则改变的条件一定是加入催化剂 | 反应达到平衡时,外界条件对平衡影响关系如图所示,则正反应为放热反应,且a>b | 物质的百分含量和温度关系如图所示,则该反应的正反应为吸热反应 | 反应速率和反应条件变化关系如图所示,则该反应的正反应为放热反应,A、B、C是气体,D为固体或液体 |
A.AB.BC.CD.D