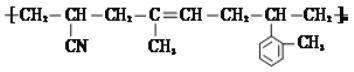题目内容
【题目】探究草酸(H2C2O4)性质,进行如下实验。(已知:室温下,0.1 mol·L1 H2C2O4的pH=1.3)
实验 | 装置 | 试剂a | 现象 |
① |
| Ca(OH)2溶液(含酚酞) | 溶液褪色,产生白色沉淀 |
② | 少量NaHCO3溶液 | 产生气泡 | |
③ | 酸性KMnO4溶液 | 紫色溶液褪色 | |
④ | C2H5OH和浓硫酸 | 加热后产生有香味物质 |
由上述实验所得草酸性质所对应的方程式不正确的是
A. H2C2O4有酸性,Ca(OH)2+ H2C2O4![]() CaC2O4↓+2H2O
CaC2O4↓+2H2O
B. 酸性:H2C2O4> H2CO3,NaHCO3+ H2C2O4![]() NaHC2O4+CO2↑+H2O
NaHC2O4+CO2↑+H2O
C. H2C2O4具有还原性,2![]() +5
+5![]() +16H+
+16H+![]() 2Mn2++10CO2↑+ 8H2O
2Mn2++10CO2↑+ 8H2O
D. H2C2O4可发生酯化反应,HOOCCOOH+2C2H5OH![]() C2H5OOCCOOC2H5+2H2O
C2H5OOCCOOC2H5+2H2O
【答案】C
【解析】
草酸(又称乙二酸)为一种二元弱酸,具有酸的通性,因此能发生中和反应,具有还原性,因为乙二酸中含有羧基因此能发生酯化反应,据此解题;
A.H2C2O4为二元弱酸,能与氢氧化钙溶液发生中和反应,生成白色沉淀草酸钙和水,因此含酚酞的氢氧化钙溶液碱性逐渐减弱,溶液红色退去,故A不符合题意;
B.产生气泡证明有CO2 产生,因此可证明酸性H2C2O4>H2CO3,反应方程式为:H2C2O4+2NaHCO3=Na2C2O4+2CO2 +2H2O 或,H2C2O4+NaHCO3=NaHC2O4+2CO2 +2H2O故B符合题意;
C.0.1 mol·L1H2C2O4的pH=1.3,说明草酸为弱酸,故草酸不可以拆分,故C不符合题意;
D.草酸(又称乙二酸),其中含有羧基因此能发生酯化反应,反应方程式正确,故D不符合题意;
综上所述,本题应选B。

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案【题目】硼(B)可形成H3BO3、NaBH4、NaBO2等化合物,用途广泛。
(1)H3BO3为一元弱酸,常温下,在水中存在如下电离平衡:
H3BO3 + H2O![]() [B(OH)4]-+H+,Ka=5.72×10-10。
[B(OH)4]-+H+,Ka=5.72×10-10。
① 25℃时,0.175 mol/L的H3BO3溶液pH约为_________(取整数)。
② 已知碳酸H2CO3的电离平衡常数为Ka1 = 4.4×10-7,Ka2 = 5.6×10-11。将少量碳酸钠溶液滴加到饱和硼酸溶液中,反应的离子方程式为_________。
(2)在容积恒定为2 L的密闭容器中加入足量BPO4和Na固体并充入一定量的H2(g)发生储氢反应:BPO4(s)+4Na(s)+2H2(g)![]() Na3PO4(s)+NaBH4(s) △H<0
Na3PO4(s)+NaBH4(s) △H<0
① 体系中H2的物质的量与反应时间的关系如表所示:
t /min | 0 | 2 | 4 | 6 | 8 | 10 |
n(H2)/mol | 2.0 | 1.5 | 1.2 | 0.9 | 0.8 | 0.8 |
下列有关叙述正确的是(填标号)_________。
a. 当容器内气体的摩尔质量不再变化时,反应达到平衡状态
b. 10 min时向容器内通入少量H2,则重新达平衡前ν(放氢)> ν(吸氢)
c. 保持温度不变,平衡后再充入1 mol H2,达新平衡时H2的浓度为0.4 mol/L
d. 升高温度,放氢速率加快,重新达到平衡时容器压强增大
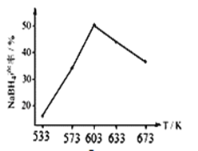
② 下图为相同时间,NaBH4的产率与反应温度的关系曲线。NaBH4的产率在603K之前随温度升高而增大的原因是_________。
(3)NaBH4(s)遇H2O(l)剧烈水解,生成氢气和NaBO2(s)。
① 通常状况下,实验测得3.8gNaBH4(s)发生水解反应放出21.6 kJ热量,写出该反应的热化学方程式_________。
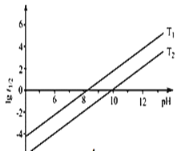
② t1/2为NaBH4水解的半衰期(水解一半所需要的时间,单位为min)。lg t1/2随pH和温度的变化如图所示。溶液pH=4时,NaBH4________(填“能”或“不能”)稳定存在;T1_________T2。(填 “>”或“<”)
【题目】氢气作为清洁能源有着广泛的应用前景,含硫天然气制备氢气的流程如图。

请回答下列问题:
Ⅰ.转化脱硫:将天然气压入吸收塔,30℃时,在T·F菌作用下,酸性环境中脱硫过程示意图如图。
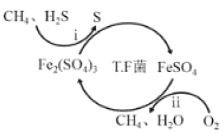
过程i的离子反应方程式为_____。
已知:①Fe3+在pH=1.9时开始沉淀,pH=3.2时沉淀完全。
②30℃时,在T·F菌作用下,不同pH的FeSO4溶液中Fe2+的氧化速率如表。
pH | 0.7 | 1.1 | 1.5 | 1.9 | 2.3 | 2.7 |
Fe2+的氧化速率 | 4.5 | 5.3 | 6.2 | 6.8 | 7.0 | 6.6 |
在转化脱硫中,请在表中选择最佳pH范围是____<pH<____,这样选择的原因是:______。
Ⅱ.蒸气转化:在催化剂的作用下,水蒸气将CH4氧化。结合如图回答问题。
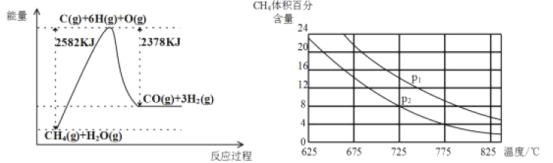
(3)①该过程的热化学方程式是_____。
②比较压强P1和P2的大小关系:P1____P2(选填“<”、“>”或“=”)。
Ⅲ.CO变换:500℃时,CO进一步与水反应生成CO2和H2。
Ⅳ.提纯:将CO2和H2分离得到H2的过程如示意图如图。
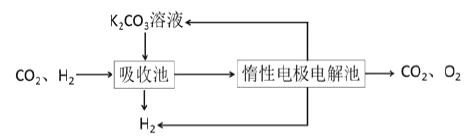
(4)吸收池中发生反应的离子方程式是______。