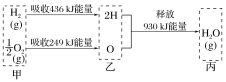
题目内容
【题目】有两种金属组成的合金A,在合适的条件下可按下图进行反应(部分产物和水省略),已知F为红褐色沉淀,请回答:
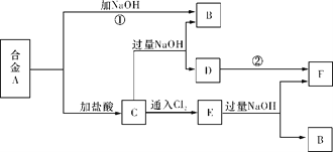
(1)溶液C的溶质主要是____________________(填化学式)。
(2)写出反应②的化学方程式_______________________________________________。描述D变F的实验现象_______________________________________________。
(3)写出反应C→E的离子方程式________________________________________。
【答案】AlCl3、FeCl24Fe(OH)2+O2+2H2O=4Fe(OH)3白色沉淀经灰绿色变为红褐色2Fe2++Cl2=2Fe3++2Cl-
【解析】
F为红褐色沉淀,应为Fe(OH)3,则说明合金A中含有Fe,则C中含有FeCl2,E含有 FeCl3;而合金A中另一种金属可与氢氧化钠反应,则应为Al;则A应为Al、Fe的合金,B为NaAlO2,由转化关系可以知道D为Fe(OH)2,据此解答。
合金A,能与氢氧化钠溶液反应,则合金A中含有铝,则B为偏铝酸钠,已知F为红褐色沉淀,则该沉淀为氢氧化铁,所以合金A中含有铁,则C为氯化铝和氯化亚铁,则D为氢氧化亚铁,C中通入氯气,氯化亚铁与氯气反应可生成氯化铁,则E为氯化铝和氯化铁,氯化铝和氯化铁溶液中加入过量的氢氧化钠可生成氢氧化铁和偏铝酸钠。
(1)由上述推断可知,溶液C的溶质主要是AlCl3、FeCl2;正确答案:AlCl3、FeCl2。
(2)反应②是氢氧化亚铁转化为氢氧化铁的过程,反应的化学方程式为:4Fe(OH)2+O2+2H2O==4Fe(OH)3。氢氧化亚铁转化为氢氧化铁的现象为:白色沉淀经灰绿色变为红褐色;正确答案:4Fe(OH)2+O2+2H2O=4Fe(OH)3 ; 白色沉淀经灰绿色变为红褐色。
(3) 反应C→E是氯化亚铁与氯气反应生成氯化铁的过程,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-;正确答案:2Fe2++Cl2=2Fe3++2Cl-。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案