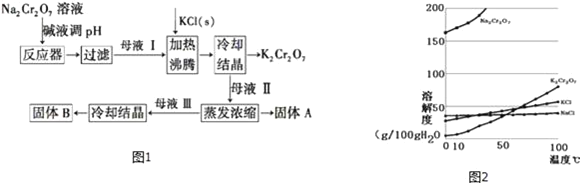
题目内容
【题目】常温下,0.1 mol/LH2C2O4水溶液中存在H2C2O4、HC2O4-和C2O42-三种形态含碳粒子,用NaOH或HCl调节该溶液的pH,三种含碳粒子的分布系数δ随溶液pH变化的关系如下图[已知:a=1.35,b=4.17,Ksp(CaC2O4)=2.3×10-9,忽略溶液体积变化]。下列说法错误的是
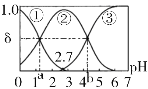
A.pH=5时,溶液中主要含碳物种浓度大小关系为:c(C2O42-)>c(H2C2O4)>c(HC2O4-)
B.已知pKa=-lgKa,则pKa2 (H2C2O4)=4.17
C.0.1mol/LNaHC2O4溶液中:c(H+)=c(OH-)+c(C2O42-)-c(H2C2O4)
D.一定温度下往CaC2O4饱和溶液中加入少量CaCl2固体,c(C2O42-)将减小,c(Ca2+)不变
【答案】AD
【解析】
根据图示可知①表示H2C2O4,②表示HC2O4-,③C2O42-的含量。
A. pH=5时,溶液中主要含碳物种浓度大小关系为:c(C2O42-)>c(HC2O4-)>c(H2C2O4),A错误;
B. Ka2 (H2C2O4) =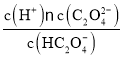 ,当溶液中c(C2O42-)=c(HC2O4-),Ka2 (H2C2O4)=c(H+)=10-4.17,所以根据pKa=-lgKa,可知pKa2 (H2C2O4)=4.17,B正确;
,当溶液中c(C2O42-)=c(HC2O4-),Ka2 (H2C2O4)=c(H+)=10-4.17,所以根据pKa=-lgKa,可知pKa2 (H2C2O4)=4.17,B正确;
C. 根据物料守恒可得:c(Na+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-),根据电荷守恒可得:c(Na+)+c(H+)= c(OH-)+c(HC2O4-)+2c(C2O42-),将两式联立整理可得c(H+)=c(OH-)+c(C2O42-)-c(H2C2O4),C正确;
D. 一定温度下CaC2O4饱和溶液中存在平衡:CaC2O4(s)![]() Ca2+(aq)+ C2O42-(aq),向其中加入少量CaCl2固体,平衡逆向移动,使c(C2O42-)减小,但最终c(Ca2+)增大,D错误;
Ca2+(aq)+ C2O42-(aq),向其中加入少量CaCl2固体,平衡逆向移动,使c(C2O42-)减小,但最终c(Ca2+)增大,D错误;
故合理选项是AD。