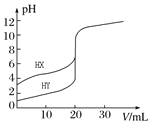
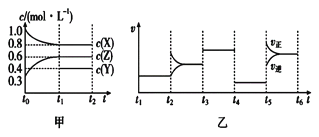
题目内容
【题目】亚硝酰氯(NOCl)是有机物合成中的重要试剂,为红褐色液体或黄色气体,具有刺鼻恶臭味,遇水反应生成一种烈化物和两种氧化物。某学习小组在实验用C12和NO制备NOCl并测定其纯度,相关实验(装置略去)如下。请回答:
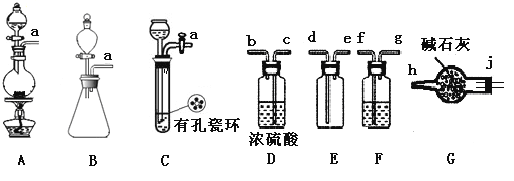
(1)制备Cl2发生装置可______ (填大写字母),反应的离子方程式为_______。
(2)欲收集一瓶干燥的氯气,选择装置,其连接顺序为:a→________(按气流方向,用小写字母表示),若用到F,其盛装药品为_________。
(3)实验室可用下图装置制备亚硝酰氯(NOCl)
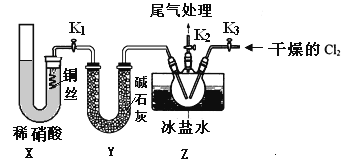
①实验室也可用B装置制备NO,上图X装置的优点为__________(至少写出两点)
②检验装置气密性并装入药品,打开k2,然后再打开____(填“k1”或“k3”),通入一段时间气体,其目的为________,然后进行其他操作,当Z有一定量液体生成时,停止实验。
③若无装肖Y,则Z中NOCl可能发生反应的化学方程式为_________
(4)取Z中所得液体mg溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用cmol/LAgNO3标准溶液滴定至终点,消耗标准溶液的体积为22.50mL.已知:Ag2CrO4为砖红色固体;Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12,则亚硝酰氯(NOC1)的质量分数为____(用代数式表示,不必化简)。
【答案】 A或B MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O或2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O fgcbdejh 饱和食盐水 排除装置内空气的干扰;可以随开随用,随关随停 K3 排尽三颈烧瓶中的空气防止NO和NOCl变质 2NOCl+H2O=2HCl+NO↑+NO2↑ 14.7375c/m×100%或写成
Mn2++Cl2↑+2H2O或2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O fgcbdejh 饱和食盐水 排除装置内空气的干扰;可以随开随用,随关随停 K3 排尽三颈烧瓶中的空气防止NO和NOCl变质 2NOCl+H2O=2HCl+NO↑+NO2↑ 14.7375c/m×100%或写成![]() ×100%
×100%
【解析】(1)实验室制备Cl2可以用二氧化锰与浓盐酸加热反应生成氯化锰、氯气和水,或者用高锰酸钾固体与浓盐酸混合反应生成氯化钾、氯化锰、氯气和水,则发生装置可选择图中的A或B,反应的离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O或2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;正确答案:A或B ;MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O或2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;正确答案:A或B ;MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O或2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O。
Mn2++Cl2↑+2H2O或2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O。
(2)制得的氯气中含有氯化氢及水蒸气,所以需要利用饱和食盐水除去氯化氢后再用浓硫酸进行干燥,然后再根据氯气的密度比空气大的性质,用向上排空气法收集,氯气是大气污染物,需要进行尾气处理,可以用碱石灰做吸收剂,故装置连接顺序为: a→fgcbdejh,F装置内其盛装饱和食盐水,除去氯化氢气体;正确答案:fgcbdejh;饱和食盐水。
(3)①实验室也可用B装置制备NO,图X装置的优点为排除装置内空气的干扰;可以随开随用,随关随停;正确答案:排除装置内空气的干扰;可以随开随用,随关随停。
②检验装置气密性并装入药品,打开k2,然后再打开k3,通入一段时间气体,其目的是为排净三颈烧瓶中的空气,防止一氧化氮和NOCl变质;正确答案:K3;排尽三颈烧瓶中的空气防止NO和NOCl变质。
③NOCl与水反应生成盐酸、一氧化氮和二氧化氮,反应的化学方程式为:2NOCl+H2O=2HCl+NO↑+NO2↑;正确答案:2NOCl+H2O=2HCl+NO↑+NO2↑。
(4)取Z中所得液体mg溶于水,取25.00mL溶液中存在:n(NOCl)=n(Cl-)=n(Ag+)=c×22.50×10-3=0.0225cmol, 则250mL溶液中,n(NOCl)=0.225c mol,所以亚硝酰氯(NOC1)的质量分数为0.225c×65.5/m×100%=14.7375c/m×100%;正确答案:14.7375c/m×100%或写成[c×22.5×10-3×10×65.5]/m×100%。

 阅读快车系列答案
阅读快车系列答案【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对消除环境污染有重要意义。
(1)NO在空气中存在如下反应:2NO(g)+O2(g)=2NO2(g)△H,上述反应分两步完成,其反应历程如下图所示:
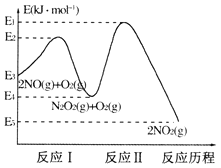
回答下列问题:
①写出反应I的热化学方程式_________。
②反应I和反应II中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g)=2NO2(g)反应速率的是 _______(填“反应I”或“反应II”);对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是________(反应未使用催化剂)。
(2)用活性炭还原法处理氮氧化物的有关反应为:C(s)+2NO(g)![]() N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及l0 min和20 min各物质平衡浓度如表所示:
N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及l0 min和20 min各物质平衡浓度如表所示:
浓度/mol/L 时间/min | NO | N2 | CO2 |
0 | 0.100 | 0 | 0 |
10 | 0.040 | 0.030 | 0.030 |
20 | 0.032 | 0.034 | 0.017 |
①T℃时,该反应的平衡常数为 ________ (保留两位有效数字)。
②在l0 min时,若只改变某一条件使平衡发生移动,20 min时重新达到平衡,则改变的条件是________
③在20 min时,保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,此时反应v正____v逆(填“>”、“<”或“=”)。
(3)NO2存在如下平衡:2NO2(g)![]() N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
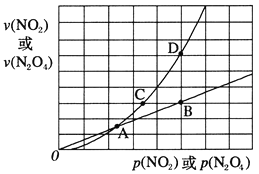
一定温度下,k1、k2与平衡常数Kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是k1=____;在上图标出点中,指出能表示反应达到平衡状态的点是 ______。