题目内容
17.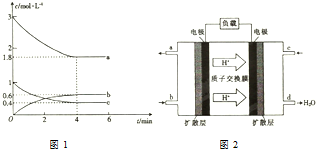 甲醇是一种低碳能源,在全球能源危机和环境污染的背景下具有良好的发展前景,在催化剂作用下可用H2(g)+CO(g)$\stackrel{催化剂}{?}$CH3OH(g),三种物质的物质的量浓度随时间变化的关系如图1所示.
甲醇是一种低碳能源,在全球能源危机和环境污染的背景下具有良好的发展前景,在催化剂作用下可用H2(g)+CO(g)$\stackrel{催化剂}{?}$CH3OH(g),三种物质的物质的量浓度随时间变化的关系如图1所示.(1)代表H2浓度变化的曲线为a(填“a”“b”或“c”).
(2)提出一条可以加快反应速率的措施:加压或者升温.
(3)0-4 min内,CH3OH的平均反应速率为:0.15mol/(L•min).
(4)我国某高校化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆.甲醇燃料电池的工作原理如图2所示.
①该电池工作时,c口通入的物质为O2,该电极为正极(填“正极”或“负极”).
②该电池工作一段时间后,当6.4g甲醇完全反应生成CO2时,消耗的氧气的体积为6.72L(标准状况下)
分析 (1)根据2H2(g)+CO(g)$\stackrel{催化剂}{?}$CH3OH反应,H2浓度变化在减小并且是CO的2倍判断;
(2)可以加快反应速率的措施为加压或者升温等;
(3)根据CH3OH的平均反应速率=$\frac{△c}{△t}$计算;
(4)在甲醇燃料电池中,燃料甲醇作负极,发生失电子的氧化反应,氧气作正极,发生得电子的还原反应,根据电极反应以及电子守恒来计算消耗的氧气的体积.
解答 解:(1)由2H2(g)+CO(g)$\stackrel{催化剂}{?}$CH3OH反应,H2浓度变化在减小并且是CO的2倍,所以代表H2浓度变化的曲线为a,故答案为:a;
(2)可以加快反应速率的措施为加压或者升温,故答案为:加压或者升温;
(3)根据图象CH3OH为生成物,即代表CH3OH浓度变化的曲线为b,则0-4 min内,CH3OH的平均反应速率=$\frac{△c}{△t}$=$\frac{0.6mol/L}{4min}$=0.15mol/(L•min),故答案为:0.15mol/(L•min);
(4)①在甲醇燃料电池中,燃料甲醇作负极,氧气作正极,电解质中的阳离子移向正极,所以c口通入的物质为氧气,该电极为正极,故答案为:O2;正极;
②当6.4g即0.2mol甲醇完全反应生成CO2时,根据总反应:2CH3OH+3O2=2CO2+4H2O,消耗氧气0.3mol,即标准状况下体积为0.3×22.4=6.72L,故答案为:6.72.
点评 本题是一道关于化学平衡图象的分析与反应速率的计算以及燃料电池的工作原理知识的考题,要求学生具有分析和解决问题的能力,难度不大.

练习册系列答案
相关题目
7.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 使甲基橙变红色的溶液:Mg2+、K+、SO42-、NO3- | |
| B. | 常温下,c(H+)/c(OH-)=1010的溶液中:Na+、NH4+、ClO-、I- | |
| C. | 水电离出的c(H+)=10-12mol•L-1的溶液:K+、Na+、CO32-、Br- | |
| D. | 含有0.1mol•LHCO3-的溶液:Na+、Fe3+、NO3-、SCN- |
5.下列排列顺序正确的是( )
| A. | 微粒半径:Mg2+>F- | B. | 稳定性:HI>HBr | ||
| C. | 酸性:H2CO3>H3PO4 | D. | 熔点:Al>Na |
12.甲烷与氧气的反应式放热反应,下列对应的图象正确的是( )
| A. |  | B. |  | C. |  | D. |  |
6.已知下述三个实验中的物质均能发生化学反应.
下列判断正确的是( )
| ① | ② | ③ |
| 将铁钉放入硫酸铜溶液中 | 向硫酸亚铁溶液中滴入几滴浓硝酸 | 将铁钉放入氯化铁溶液中 |
| A. | 实验①和③中的铁钉只作还原剂 | |
| B. | 实验③中反应的离子方程式为Fe+Fe3+═2Fe2+ | |
| C. | 实验②中Fe2+既显氧化性又显还原性 | |
| D. | 上述实验证明氧化性:Fe3+>Fe2+>Cu2+ |
 .
.

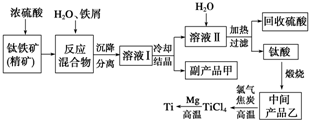 金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀等性质被广泛用在高新科技材料和航天领域中.
金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀等性质被广泛用在高新科技材料和航天领域中.