题目内容
二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,而且与Cl2相比不会产生对人体有潜在危害的有机氯代物。制备ClO2有下列两种方法:
方法一:2 NaClO3+4 HCl="2" ClO2↑+ Cl2↑+ 2 NaCl+2 H2O
方法二:2 NaClO3+H2O2+H2SO4=2 ClO2↑+ O2↑+Na2SO4+2 H2O
(1)方法一的离子方程式为 ;
(2)方法二中被氧化的物质是 ,若反应中有0.1mol电子转移,则产生的ClO2气体在标准状况下的体积为 L;在下面的化学式上标出电子转移的方向和数目
2 NaClO3+H2O2+H2SO4=2 ClO2↑+ O2↑+ Na2SO4+2 H2O
(3)某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO—与ClO3—的浓度之比为1:3,则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为 ;
(1)2ClO3-+4 H++2Cl-="2" ClO2↑+ Cl2↑+ 2 H2O
(2)H2O2, 2.24 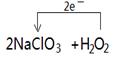
(3)4:1
解析试题分析:(1)根据是否是能溶于水的电解质,改写可得离子方程式。
(2)方法二H2O2中O元素的化合价由-1价转化为0,所以H2O2为还原剂被氧化;ClO2与电子的对应关系为:ClO2~e?,则V(ClO2)=0.1mol×22.4L/mol=2.24L;H2O2中O失去2e?,NaClO3中Cl得到2e?,可标出电子转移。
(3)假设反应中生成了1mol NaClO和3mol NaClO3,则有1×1mol+5×3mol=16mol电子发生转移,由得失电子守恒知,必有16mol氯原子被还原,即被还原的氯元素与被氧化的氯元素的物质的量之比为16mol:(1mol+3mol)=4:1。
考点:本题考查氧化还原反应、电子转移及其计算、离子方程式的书写。

 备战中考寒假系列答案
备战中考寒假系列答案研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)利用反应:6NO2+8NH3 7N2+12H2O可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下的体积是 L。
7N2+12H2O可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下的体积是 L。
(2)①已知:2SO2(g)+O2(g) 2SO3(g) ΔH=?196.6 kJ·mol–1
2SO3(g) ΔH=?196.6 kJ·mol–1
2NO(g)+O2(g) 2NO2(g) ΔH=?113.0 kJ·mol–1
2NO2(g) ΔH=?113.0 kJ·mol–1
请写出NO2与SO2反应生成SO3(g)和NO的热化学方程式 。
②一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO2的同时生成1 molNO2
③测得上述反应平衡时NO2与SO2体积比为1:6,则该反应的平衡常数K= 。
(3)汽车尾气中的一氧化碳可通过如下反应降低其浓度:CO(g)+1/2O2(g) CO2(g)。已知某温度下,在两个恒容密闭容器中进行该反应,容器中各物质的起始浓度及正、逆反应速率关系如下表所示。请用“>”或“<”或“=”填写表中的空格。
CO2(g)。已知某温度下,在两个恒容密闭容器中进行该反应,容器中各物质的起始浓度及正、逆反应速率关系如下表所示。请用“>”或“<”或“=”填写表中的空格。
| 容器编号 | c(CO)/mol·L–1 | c(O2)/mol·L–1 | c(CO2)/mol·L–1 | υ(正)和υ(逆) 大小比较 |
| ① | 2.0×10–4 | 4.0×10–4 | 4.0×10–4 | υ(正)=υ(逆) |
| ② | 1.0×10–3 | 4.0×10–4 | 5.0×10–4 | υ(正) υ(逆) |
(1)如图是课本中“四种基本反应类型与氧化还原反应的关系”图,“H2+CuO  Cu+H2O”反应属于图中的区域 (填序号)。下列反应中属于区域7的有 。
Cu+H2O”反应属于图中的区域 (填序号)。下列反应中属于区域7的有 。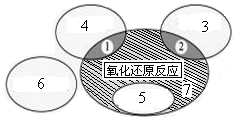
A.2H2+O2 2H2O 2H2O |
B.2NaHCO3 Na2CO3+H2O+CO2↑ Na2CO3+H2O+CO2↑ |
| C.Zn+H2SO4=ZnSO4+H2↑ |
D.CuO+CO Cu+CO2 Cu+CO2 |
O2、H2CrO4、Cr(OH)3、H2O、H2O2
已知:该反应中H2O2只发生如下过程:H2O2→O2。
①该反应中,发生还原反应的物质是 。
②写出该反应的化学方程式(不用配平)
_________+________ → ________+________+________
(3)3Cl2+8NH3
 N2+6NH4Cl
N2+6NH4Cl①用双线法表示该反应转移的电子数目和方向。
②该反应中,氧化剂与还原剂分子个数之比为 。
(4)在一定条件下,PbO2与Cr3+反应,产物是Cr2O72—和Pb2+。若与1molCr3+完全反应所需PbO2的物质的量为 。



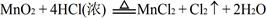 ,结合以上反应原理,则MnO2、KMnO4、Cl2的氧化性由强到弱的顺序是: 。
,结合以上反应原理,则MnO2、KMnO4、Cl2的氧化性由强到弱的顺序是: 。 ,找出其中一个变化与“
,找出其中一个变化与“ ”组成一个反应,写出该反应的离子方程式____ 。
”组成一个反应,写出该反应的离子方程式____ 。
 由此可知,高锰酸根离子(MnO—4)反应后的产物与 有关。
由此可知,高锰酸根离子(MnO—4)反应后的产物与 有关。
